PD-(L)1/VEGF双抗丨康方上市在即,普米斯开展III期
原创 sephirah Biotech前瞻 2024-05-20 09:57 上海


本期看点

 普米斯生物丨PD-L1/VEGF双抗
普米斯生物丨PD-L1/VEGF双抗普米斯生物自主研发的抗PD-L1/VEGF双特异性抗体新药PM8002注射液先后布局三阴乳腺癌、小细胞肺癌、非小细胞肺癌、宫颈癌等多个瘤种的多项II期临床研究,而三阴乳腺癌已经进入到III期临床阶段。

 康方生物丨PD-1/VEGF双抗AK112 是康方生物自主研发的全球首创 PD-1/VEGF 双特异性抗体,目前正在国内开展 3 项针对 NSCLC 的 III 期注册临床研究,EGFR-TKI 耐药适应症的 NDA 已获受理,有望 2024 年获批上市;此外,海外针对 NSCLC 的临床 2 项 III 期注册性研究正在顺利推进。
康方生物丨PD-1/VEGF双抗AK112 是康方生物自主研发的全球首创 PD-1/VEGF 双特异性抗体,目前正在国内开展 3 项针对 NSCLC 的 III 期注册临床研究,EGFR-TKI 耐药适应症的 NDA 已获受理,有望 2024 年获批上市;此外,海外针对 NSCLC 的临床 2 项 III 期注册性研究正在顺利推进。


普米斯生物丨PD-L1/VEGF双抗
2024年5月20日,普米斯生物在Clinicaltrials.gov网站上注册了PM8002(20mg/kg Q2W)联合化疗一线治疗局部晚期或转移性三阴乳腺癌的III期临床试验。该三期临床试验计划入组360例局部晚期或转移性三阴乳腺癌患者,预计2027年初步完成。
Cited by:Clinicaltrials.gov
2024年3月1日,CDE官网公示,普米斯生物申报的PM8002注射液拟纳入突破性治疗品种,针对适应症为联合注射用白蛋白结合型紫杉醇一线治疗不可手术的局部晚期/复发转移性三阴性乳腺癌。
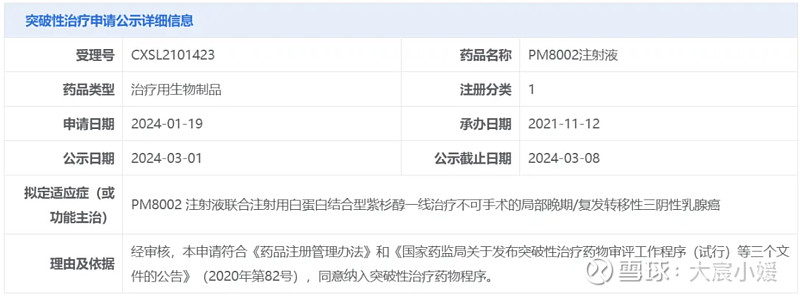
截图来源:CDE官网
PM8002是一款双特异性抗体药物,由人源化的抗PD-L1单域抗体(VHH)融合到一个含有Fc-沉默突变的抗VEGF-A IgG1抗体上构成,现已在国内开展针对三阴乳腺癌、小细胞肺癌、非小细胞肺癌、宫颈癌、肝癌等多个瘤种的多项II期临床研究。我们具体来看下PM8002在小细胞肺癌、三阴性乳腺癌(TNBC)的研究结果。
PM8002丨2023 ESMO
PM8002联合紫杉醇作为小细胞肺癌(SCLC)二线疗法的II期安全性和疗效研究(壁报1992P)
PM8002联合紫杉醇作为SCLC患者的二线治疗显示出令人鼓舞的抗肿瘤活性和可接受的毒性。一线治疗时无论接受过免疫联合化疗或者单化疗的患者,在本试验中均得到良好的疾病控制(DCR>80%),客观反应率高于目前已知的二线疗法。其中既往未接受过免疫治疗的患者,无进展生存期(PFS)接近一线治疗;接受过免疫治疗的患者,多数尚在治疗中,PFS有望进一步延长。
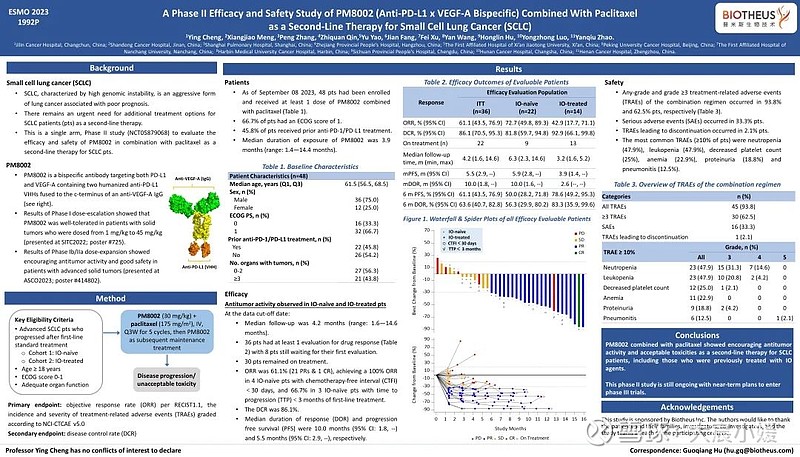
2023 ESMO PM8002 Poster
PM8002丨2023 SABCS
TNBC恶性程度较高、易复发,患者5年生存率较低。普米斯于圣安东尼奥乳腺癌大会(SABCS)2023年会(摘要编号:PS08-06)展示的临床数据显示:
PM8002联合白蛋白紫杉醇方案在晚期TNBC 的一线治疗中显示出令人鼓舞的抗肿瘤活性和良好的安全性,客观缓解率(ORR)达78.6%,疾病控制率(DCR)达95.2%。
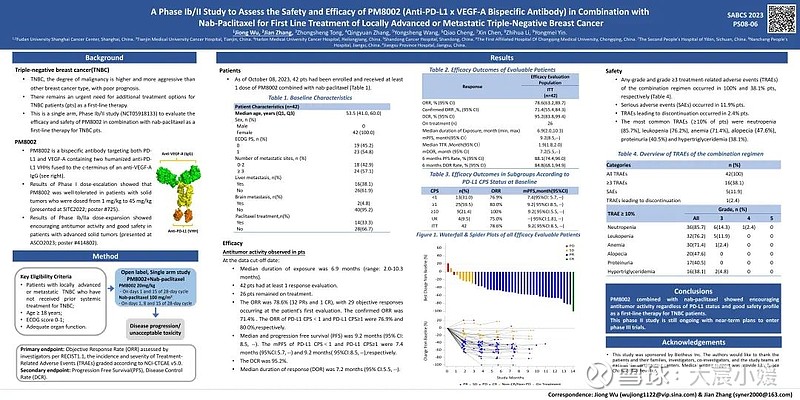
2023 SABCS PM8002 Poster
普米斯生物合作BioNTech

根据协议条款,BioNTech将获得普米斯用于治疗恶性肿瘤的一款临床前研究阶段双特异性抗体和一款临床研究阶段单克隆抗体的全球独家选择权。此外,普米斯将多个在研临床前纳米抗体项目专属授权给BioNTech,并根据其需求提供指定靶向纳米抗体开发服务。本号将持续关注普米斯相关产品的研究进展。

 康方生物丨PD-1/VEGF双抗
康方生物丨PD-1/VEGF双抗2023年8月24日, CDE官网公示显示,康方生物全球首创的依沃西单抗(PD-1/VEGF双抗,AK112)被纳入拟优先审评品种公示名单。此前,依沃西单抗三个肺癌相关适应症被CDE纳入突破性治疗品种名单(BTD)。2023年8月1日,依沃西单抗的首个新药上市许可申请(NDA)获得CDE受理。此次依沃西单抗再被授予优先审评资格,是依沃西单抗临床价值被认可的重要体现,依照相关法规程序,将有助于加速依沃西单抗的获批上市进程。
 截图来源:CDE官网依沃西是康方生物基于其独特的Tetrabody技术设计的全球行业内首个进入III期临床研究的PD-1/VEGF双特异性抗体。可阻断PD-1与PD-L1和PD-L2的结合,并同时阻断VEGF与VEGF受体的结合。既往发表的机制文献中可知:鉴于VEGF和PD-1在肿瘤微环境中的共表达,与联合疗法相比AK112作为单一药物同时阻断这两个靶点,可能会更有效地阻断这两个通路,从而增强抗肿瘤活性。而随着MNC对于国内Biotech企业的关注度提高,2022年12月,依沃西单抗(AK112)以总交易额高达50亿美金(5亿美金首付款),外加销售净额两位数提成的合作方案,授予美国Summit Therapeutics公司在美国、欧洲、加拿大和日本的开发独家许可权,创下中国单个创新药物对外权益许可最高交易金额纪录。
截图来源:CDE官网依沃西是康方生物基于其独特的Tetrabody技术设计的全球行业内首个进入III期临床研究的PD-1/VEGF双特异性抗体。可阻断PD-1与PD-L1和PD-L2的结合,并同时阻断VEGF与VEGF受体的结合。既往发表的机制文献中可知:鉴于VEGF和PD-1在肿瘤微环境中的共表达,与联合疗法相比AK112作为单一药物同时阻断这两个靶点,可能会更有效地阻断这两个通路,从而增强抗肿瘤活性。而随着MNC对于国内Biotech企业的关注度提高,2022年12月,依沃西单抗(AK112)以总交易额高达50亿美金(5亿美金首付款),外加销售净额两位数提成的合作方案,授予美国Summit Therapeutics公司在美国、欧洲、加拿大和日本的开发独家许可权,创下中国单个创新药物对外权益许可最高交易金额纪录。
敬请期待2024 ASCO大会上有关 PD-(L)1/VEGF双抗的内容,剧透如下:
Abstract 8508:
Ivonescimab combined with chemotherapy in patients with EGFR-mutant non-squamous non–small cell lung cancer who progressed on EGFR tyrosine-kinase inhibitor treatment (HARMONi-A): A randomized, double-blind, multi-center, phase 3 trial.
First Author: Li Zhang, MD (口头报告)
Abstract 4095:
The safety and efficacy of ivonescimab in combination with chemotherapy as first-line treatment foradvanced biliary tract cancer.
First Author: Jieer Ying
Abstract 5524:
Efficacy and safety of PM8002, a bispecific antibody targeting PD-L1 and VEGF-A, as a monotherapy in patients with solid tumors: Clinical data from advanced cervical cancer and platinum-resistant recurrent ovarian cancer cohorts.
First Author: Lingying Wu, MD, PhD
Abstract 8533:
A phase Ib/IIa trial to evaluate the safetyand efficacy of PM8002, a bispecific antibody targeting PD-L1 and VEGF-A, as a monotherapy in patients withadvanced NSCLC.