和黄医药赛沃替尼新适应症申报上市,一线治疗NSCLC
2024-03-27
 3月27日,和黄医药赛沃替尼片新适应症上市申请获CDE受理。根据和黄医药近期发布的年度报告,推测此次申报适应症为:一线及二线治疗MET外显子14跳跃突变非小细胞肺癌(NSCLC)患者,有望将赛沃替尼片在中国的适应症拓展到一线患者。
3月27日,和黄医药赛沃替尼片新适应症上市申请获CDE受理。根据和黄医药近期发布的年度报告,推测此次申报适应症为:一线及二线治疗MET外显子14跳跃突变非小细胞肺癌(NSCLC)患者,有望将赛沃替尼片在中国的适应症拓展到一线患者。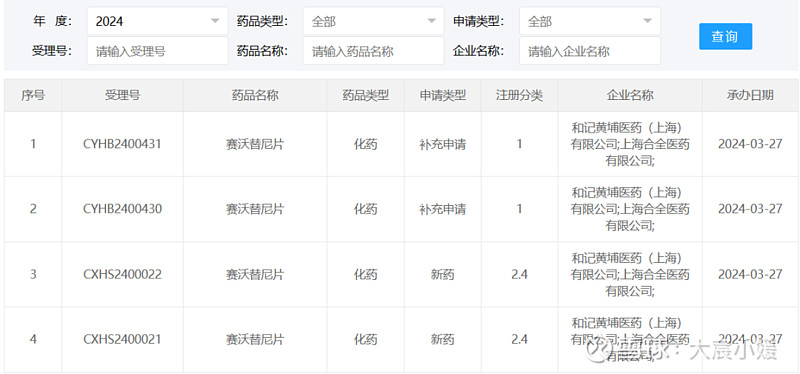 赛沃替尼(savolitinib,沃瑞沙)是一种口服的高选择性小分子c-Met抑制剂,最初由和黄医药开发,2011年,和黄医药与阿斯利康达成一项全球许可协议,将共同开发沃瑞沙并促进其商业化。和黄医药与阿斯利康合作负责赛沃替尼的临床开发,在中国由和黄医药主导,在海外则由阿斯利康主导。此外,和黄医药负责赛沃替尼在中国的上市许可、生产和供应,而阿斯利康则负责实现沃瑞沙在中国乃至全球范围内的商业化。赛沃替尼的销售收入由阿斯利康确认。2021年6月,赛沃替尼在中国获附条件批准,用于治疗接受全身性治疗后疾病进展或无法接受化疗的MET外显子14跳跃突变的NSCLC患者。赛沃替尼自2023年3月1日起被纳入国家医保药品目录,用于治疗含铂化疗后疾病进展或不耐受标准含铂化疗的MET外显子14跳变的局部晚期或转移性NSCLC成人患者。2023年,赛沃替尼中国销售额为4610万美元。在2023年财报中,和黄医药还汇报了赛沃替尼另外3项III期研究新的进展:
赛沃替尼(savolitinib,沃瑞沙)是一种口服的高选择性小分子c-Met抑制剂,最初由和黄医药开发,2011年,和黄医药与阿斯利康达成一项全球许可协议,将共同开发沃瑞沙并促进其商业化。和黄医药与阿斯利康合作负责赛沃替尼的临床开发,在中国由和黄医药主导,在海外则由阿斯利康主导。此外,和黄医药负责赛沃替尼在中国的上市许可、生产和供应,而阿斯利康则负责实现沃瑞沙在中国乃至全球范围内的商业化。赛沃替尼的销售收入由阿斯利康确认。2021年6月,赛沃替尼在中国获附条件批准,用于治疗接受全身性治疗后疾病进展或无法接受化疗的MET外显子14跳跃突变的NSCLC患者。赛沃替尼自2023年3月1日起被纳入国家医保药品目录,用于治疗含铂化疗后疾病进展或不耐受标准含铂化疗的MET外显子14跳变的局部晚期或转移性NSCLC成人患者。2023年,赛沃替尼中国销售额为4610万美元。在2023年财报中,和黄医药还汇报了赛沃替尼另外3项III期研究新的进展:于2024年年底完成一项中国关键性III期SACHI研究的患者招募,该项研究旨在评估赛沃替尼联合奥希替尼用于治疗EGFR抑制剂治疗后疾病进展的MET扩增NSCLC患者;
将于2024年年底完成中国关键性III期研究SANOVO研究的患者招募,该项研究旨在评估赛沃替尼联合奥希替尼用于治疗伴有EGFR突变和MET过表达的NSCLC患者的一项中国关键性III期研究 ;
已完成关键性全球II期SAVANNAH研究的患者招募,该研究在因MET扩增或过表达导致奥希替尼治疗后疾病进展的NSCLC患者中展开,已获美国FDA授予快速通道资格,若该研究取得积极结果,将于2024年年底左右与美国FDA就可能的新药上市申请提交进行沟通。