$荣昌生物-B(09995)$ Seagen有放弃荣昌RC48的嫌疑
Seagen 将在 2023 年美国临床肿瘤学会泌尿生殖系统癌症研讨会上重点介绍尿路上皮癌的研究
02/13/2023
- 数据演示表明 PADCEV(enfortumab vedotin-ejfv)在多种类型的尿路上皮癌中 -®
- 患者报告的结果强调了Seagen致力于满足患者需求和生活质量的承诺 -
华盛顿州博塞尔--(美国商业资讯)(纳斯达克股票代码:SGEN)今天宣布,在即将于2023年2月16日至18日举行的美国临床肿瘤学会泌尿生殖系统癌症研讨会(ASCO-GU)上展示以PADCEV(enfortumab vedotin-ejfv)为特色的新数据。讲台演讲将展示注册期 1b/2 EV-103 队列 K 研究中值得注意的患者报告结果。®
队列K正在评估与安斯泰来合作开发的恩福单抗维多汀作为单一疗法,并与默克的抗PD-1疗法可瑞达(pembrolizumab)联合使用,作为无法切除的局部晚期或转移性尿路上皮癌(la/mUC)患者的一线治疗,这些患者不符合接受顺铂化疗的条件。默克在美国和加拿大以外被称为默沙东。®
“患者是我们工作的核心,我们致力于为尿路上皮癌患者和具有挑战性的临床需求开发创新的解决方案,”Seagen高级副总裁兼后期开发负责人Marjorie Green博士说。“我们期待在ASCO GU上展示PADCEV的患者报告结果,并进一步解决癌症患者未满足的需求,以便更好地支持这个社区并提高他们的生活质量。
Seagen赞助研究将提供的其他值得注意的数据包括EV-103队列K研究的研究人员评估对确认的客观缓解率的亚组分析,以及来自患者,护理人员和医生的定性见解以及来自真实世界研究的数据。正在进行的enfortumab vedotin在非肌肉浸润性和肌肉浸润性膀胱癌中的试验也将在会议的海报展示中展示,展示Seagen在广泛的尿路上皮癌中的参与。
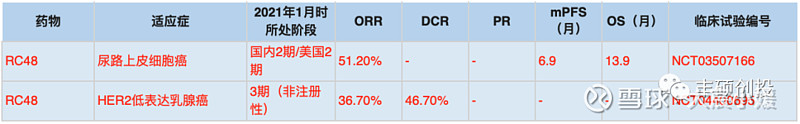
RC48布局了较为“小众”的尿路上皮癌适应症,以及HER2低表达适应症,并且疗效不俗。而当时,很少有HER2 ADC药物开展尿路上皮癌临床试验,几大经典HER2单抗曲妥珠、帕妥珠以及HER2 ADC药物T-DM1挑战HER2低表达癌种均以失败告终。
全部讨论
美国政府的施压,让美国生物技术公司断绝与中国公司的合作,说明中国生物技术快速发展让美国感受到了压力
$荣昌生物-B(09995)$ 2022年SEAGEN年报披露的对RC48的计划:Disitamab vedotin
Effective in September 2021, we and RemeGen entered into an exclusive license agreement to develop and commercialize disitamab vedotin, a novel HER2-targeted ADC, which has shown anti-tumor activity in several solid tumor types across a spectrum of HER2 levels, including urothelial, gastric and breast cancer, in all countries outside of RemeGen's territory of Asia, excluding Japan and Singapore. We have a broad clinical development program planned including an ongoing phase 2 clinical trial evaluating disitamab vedotin as monotherapy in previously treated HER2-expressing metastatic urothelial cancer and a phase 3 clinical trial evaluating disitamab vedotin in combination with pembrolizumab in first-line treatment for HER2-expressing metastatic urothelial cancer that is expected to initiate in 2023.
泰它西普和维迪西妥真有可能联袂在美国上市。
宣布FDA接受PADCEV联合可瑞达(帕博利珠单抗)用于一线晚期或转移性尿路上皮癌的补充生物制品许可申请(sBLA);PDUFA 日期 2023 年 4 月 21 日:®2022 年 12 月,Seagen、安斯泰来和默克宣布 FDA 授予 sBLA 优先审查,并将目标行动日期定为 2023 年 4 月 21 日。该申请正在根据 1b/2 期 EV-103 临床试验(也称为 KEYNOTE-869)剂量递增/队列 A 和队列 K 的结果寻求加速批准。该试验评估了PADCEV联合可瑞达作为一线治疗不适合接受顺铂化疗的不可切除的局部晚期或转移性尿路上皮癌患者的疗效。已完成一线晚期尿路上皮癌全球3期临床试验EV-302的入组: 2022年11月,Seagen及其合作伙伴安斯泰来完成了EV-302试验的患者入组,该试验评估了PADCEV和可瑞达联合化疗与单独化疗治疗既往未经治疗的局部晚期或转移性尿路上皮癌患者的疗效。EV-302 包括符合或不符合顺铂化疗条件的转移性尿路上皮癌患者。该试验旨在支持全球注册,如果基于EV-103获得加速批准,则可能作为验证性试验。在美国临床肿瘤学会泌尿生殖系统癌症(ASCO GU)研讨会上展示EV-103试验的新数据: Seagen将重点介绍PADCEV的新数据,包括讲台演讲,展示EV-103队列K研究中值得注意的患者报告结果。ASCO GU 会议将于 2023 年 2 月 16 日至 18 日举行。

