又一家企业终止二代CD47抗体开发,预测CD47的联合探索可能
原创 北北1
发表于山东
——CD47赛道快讯——
2023年1月13日,专注于CD47开发的Arch Oncology公司宣布已经终止了其在抗CD47抗体上的研发工作,目前公司大部分员工已经离职。Arch Oncology是最早一批布局CD47靶点的企业之一,AO-176是公司的最为领先的管线。根据公司离职员工所述,Arch Oncology已经取消了对AO-176的临床开发。
AO-176经过一款高度差异化设计的抗CD47抗体,除了阻断CD47/SIRPα信号通路外,可优先与肿瘤细胞结合,而非与正常细胞结合。并且其能在酸性微环境(低pH)中能更有效地结合肿瘤。更重要的是,AO-176还可直接杀死肿瘤细胞,而非ADCC。AO-176已经进展到临床Ⅰ/Ⅱ期阶段。

针对CD47抗体研发,失利的消息早已有之。
2022年8月16日,天境生物修订了先前与艾伯维达成的有关Lemzoparlimab达成的19.4亿美元的授权协议,据修订后协议,双方将在其他候选CD47抗体继续合作,基于此,天境生物将获得12.95亿美元的开发、监管、商业里程碑付款以及特许使用权费。同时,艾伯维表示将终止“Lemzoparlimab(CD47单克隆抗体)+阿扎胞苷+venetoclax”在骨髓增生异常综合征和急性髓细胞性白血病的Ⅰ期临床试验。天境表示,这个决定不是基于任何特定/意外的安全问题。而天境将继续致力于lemzoparlimab的开发,最近计划在国内启动一项治疗骨髓增生异常综合征的Ⅲ期临床试验。2022年1月25日,吉利德宣布部分暂停CD47抗体+阿扎胞苷联合治疗的所有临床研究,CD47抗体其他临床研究则不受影响。


停止联用的原因是由于研究者发现在Magrolimab+阿扎胞苷联合治疗临床研究的不同试验组中,研究者报告的可疑的意外严重副作用(suspected unexpected serious adverse reactions (SUSARs) )出现明显的不平衡,FDA要求该联合治疗的临床研究部分暂停。部分暂停期间,Magrolimab+阿扎胞苷联合治疗的所有临床停止筛选与入组,已经入组的患者可以继续接受治疗,并严密监控。
——CD47介绍——

明星靶点CD47,研发过程一波三折,也是饱受争议的一个靶点,因为从理论到实践是有很大的差距的,在新基药业暂停了相关试验后,更是让CD47蒙上了阴影。而随着龙头公司Forty Seven被Gilead以49亿美金的价格收购,受到的关注逐渐增多。相继有吉利德、艾伯维、勃林格殷格翰等大型药企布局该靶点,赛道逐渐又热络起来。
收购方研发方
价格
勃林格殷格翰
Surface Oncology3700万美元
吉列德
Forty Seven49亿美元
艾伯维
天境生物
19.4亿美元
辉瑞
Trillium Therapeutics2500万美元
在 医药界的苹果,抗病毒药物研发一哥吉列德公司的奇迹之路 一文中,对于吉列德公司有过介绍,大手笔收购目前临床开发速度最快的CD47龙头Forty Seven,相信是非常看好这赛道。但在搜集和整理资料的过程,越发觉得,CD47为何如此受争议。
CD47信息
CD47信号路径
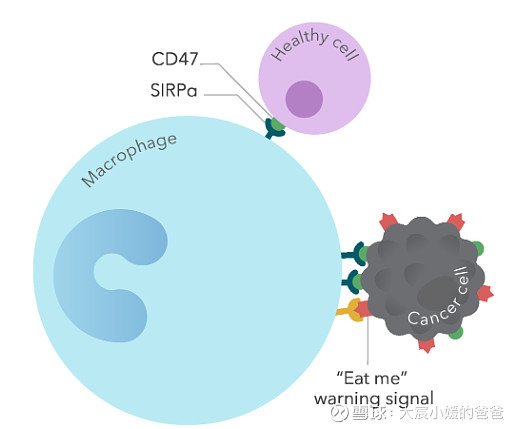
资料来源:Forty Seven公开资料
肿瘤细胞上高表达的CD47,能够向巨噬细胞传递“别吃我”信号(与巨噬细胞表面的SIRPα结合),并战胜肿瘤细胞上表达的“吃我”信号(如钙网织蛋白等),从而屏蔽巨噬细胞的吞噬功能。那么,如果利用单抗等来阻断CD47/SIRPα信号通路,就可以恢复巨噬细胞对肿瘤细胞的吞噬,这当然是一种理想的状态。但一旦可行,就可以具备广谱的抗癌能力。所以这赛道,具备超强的吸引力。
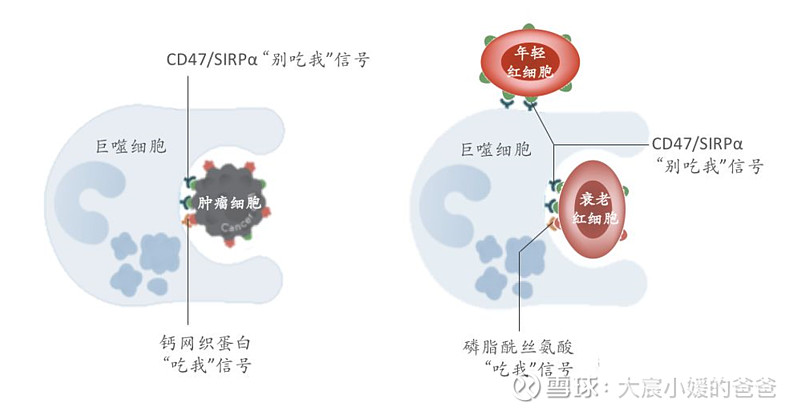
CD47在肿瘤发展和维持红细胞平衡中扮演的作用
但是CD47靶点成药最不可回避的问题就是安全性问题,CD47也参与维持体内红细胞的平衡:CD47在体内的红细胞表面也会表达,在衰老红细胞表面,CD47表达量下调或发生构象改变,“别吃我”信号降低,同时磷脂酰丝氨酸等“吃我”信号的表达提升,促进巨噬细胞对衰老红细胞的吞噬。CD47治疗药物杀伤肿瘤细胞的同时,会不可避免的误伤红细胞。
——成药理论缺陷——
在终止的几项试验结果,也验证了这一点。贫血、血小板减少症等已经成为部分在研CD47待选物的拦路虎。因此,CD47药物开发的核心,就是如何在保护红细胞的同时,最大程度地杀伤肿瘤细胞, 也是我为何对于当下所谓的三抗和四抗等产品的持疑。人体免疫系统是非常精密的系统,触发的靶点越少,引起的副反应才会更低,才更具有成药的可能。
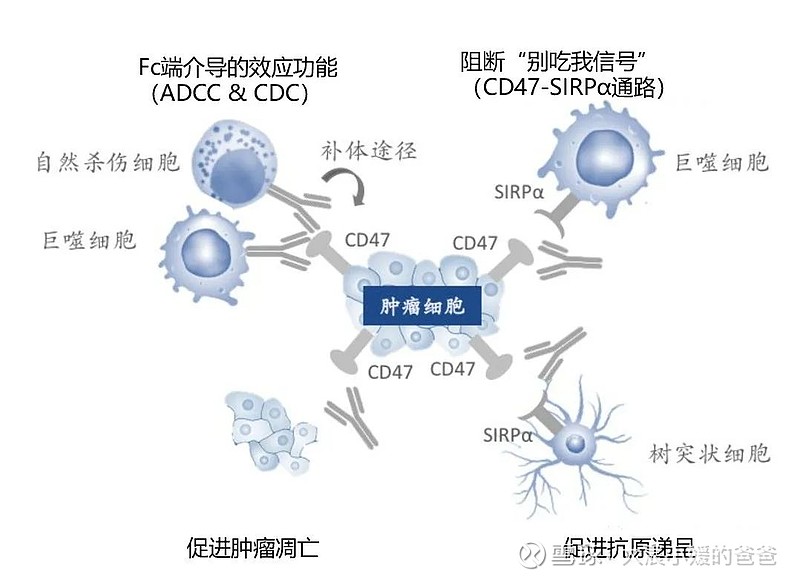
CD47靶向药物的4种抗肿瘤机制
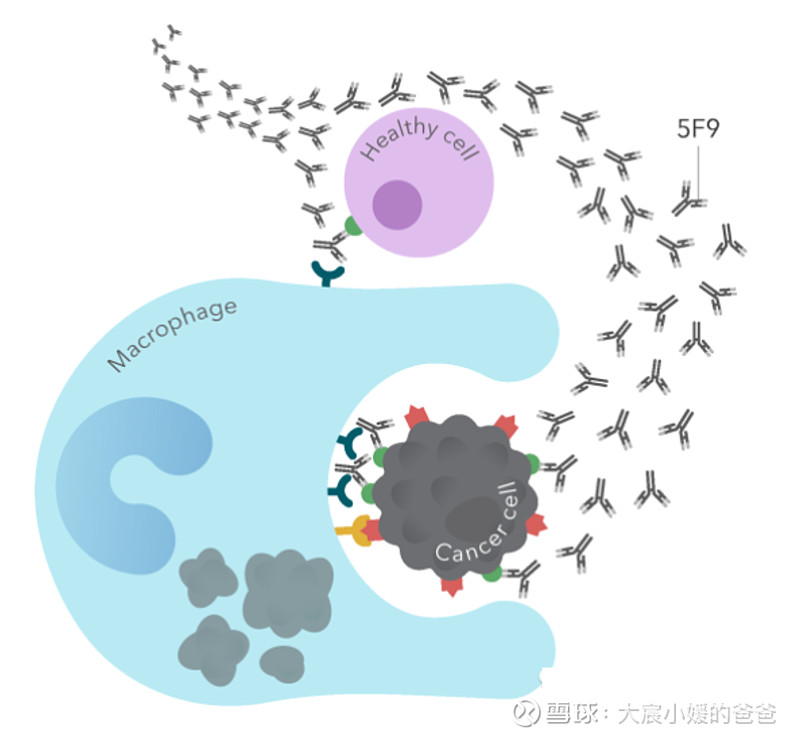
作用机理主要包括上图4个方面。其中,最为核心的两种作用机制是:阻断CD47/SIRPα“别吃我“信号诱发的巨噬细胞吞噬作用、或是由单克隆抗体Fc端引起的传统效应功能,如ADCC(抗体依赖的细胞介导的细胞毒性作用)和CDC作用(补体依赖的细胞毒性作用)。
两种机制也是一把双刃剑,这两种效应中,如果Fc端引起ADCC和CDC作用过强,那么必然会大量杀伤红细胞,造成严重的毒性问题。但相反,若完全摒弃Fc端介导的效应,只依赖CD47/SIRPα信号通路本身发挥的生物学功能,则并不足以激活显著的抗肿瘤应答。这种进退维谷的处境,让CD47药物的开发从一开始便陷入僵局。
以Celgene、Forty Seven、Arch Oncology、Surface Oncology为代表的主流做法是,开发Fc端为IgG4型的CD47抗体,而不是能够引发强烈ADCC和CDC效应的IgG1型抗体。这样的策略将降低对红细胞、血小板的影响,但已有大量数据证明用IgG4替代IgG1将大幅削弱CD47单抗对于肿瘤细胞的杀伤能力。
安全性是提高了,但药效降低,也是可以预见的事实。所以,在临床试验方案策略制定时,CD47单抗与其他药物的联用,就成为主流方案。特别是联用本身需要巨噬细胞和自然杀伤细胞吞噬作用、依赖ADCC效应发挥抗肿瘤效果的靶向药。或是能够调节免疫系统的PD-1/PD-L1抑制剂。我们自然会想到,基于CD47的双特异性抗体也自然是另一个可能的研发方向。
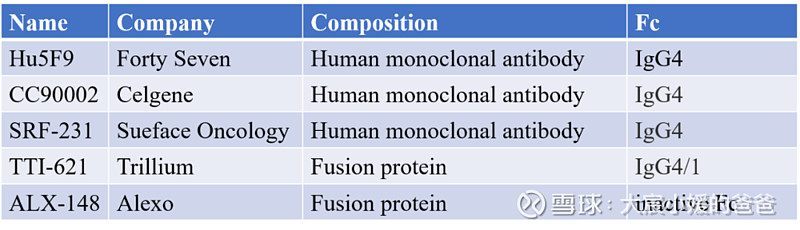
第二种解决方案是降低CD47药物对红细胞的结合能力,从而避免对红细胞的杀伤,Trillium采用的就是这种策略。Trillium的产品TTI-621是SIRP 蛋白与抗体Fc端组成的融合蛋白,对红细胞只有微弱的结合能力(可能与红细胞膜上CD47的构象改变有关),因此可以使用杀伤作用更强的IgG1型Fc端。但TTI-621仍然能够与人血小板和白细胞结合,因此仍有可能导致血小板减少症或白细胞减少症。
另外,提高安全性的方式就是通过“小剂量诱导+有效剂量维持”的给药方案,对于贫血副作用降低起到了一定的效果。
国内布局CD47的企业不少,天境生物、信达生物、宜明昂科、康方生物都有参与。以康方生物的CD47的人源化单抗(AK117,IgG4 亚型)为例,看下具体国内Biotech企业在该靶点的工程化改造技术和相应的安全性数据。

在第35届肿瘤免疫治疗学会年会(SITC 2020)上,康方生物(9926.HK)以壁报的形式展示公司自主研发的下一代靶向CD47的人源化单抗(AK117)的首次人体临床研究进展,标题为《一项评估下一代抗CD47单抗(AK117)用于治疗复发/难治性的晚期或转移性实体瘤或淋巴瘤患者的安全性、药代动力学和抗肿瘤活性的I期临床研究》。
AK117正在澳洲开展晚期实体瘤和淋巴瘤患者的剂量递增临床试验,目前20mg/kg QW队列的受试者给药正在筹备中。AK117的研究显示:
AK117在已完成的0.3mg/kg,1mg/kg和3mg/kg以及正在进行的10mg/kg QW队列的受试者中,均未发生药物相关的贫血症状,无与治疗相关的3级或以上不良事件,因此无需使用预激剂量(priming dose);
各队列受试者对药物耐受性良好,无剂量限制性毒性(DLT)事件发生;
受试者外周血T细胞的CD47的受体占有率在3mg/kg QW队列达到并维持100%的水平;
在临床前研究中,AK117在保有良好的抗原结合活性、促吞噬活性及抗肿瘤的药理学活性的同时,展示出了区别于其它抗CD47抗体药物的差异化特征:
AK117不引起红细胞聚集;
AK117介导巨噬细胞对红细胞吞噬的活性显著弱于对肿瘤细胞的吞噬;
相较于其他CD47抗体所表现出的明显贫血症状,AK117在食蟹猴中仅出现轻微的红细胞变化,并且未观察到对血小板的毒性作用。
2021年7月,AK117完成澳洲I期剂量爬坡试验,AK117在各个剂量爬坡队列受试者(0.3mg/kg - 45mg/kg QW)中均未发生DLT(剂量限制性毒性)和未出现有临床意义的贫血,各队列受试者对药物耐受性良好,无需使用低剂量预激给药。获得国家药品监督管理局(NMPA)批准,开展联合阿扎胞苷治疗急性髓系白血病(AML)的Ib/II期临床研究。
理论到实践,真的有很长的路要走,中间的摸索过程,崎岖宛转。CD47这个准成药靶点,需要更多精巧的设计摸索,特别期待康方生物、天境生物等二代CD47单抗,有成药的可能。
鉴于本身对于CD47赛道一直追踪,就潜在的CD47抗体未来的研发思路进行整理。
CD47抗体在胰腺癌治疗领域的研究探索可能性
——致癌KRAS信号通过激活CD47驱动肺腺癌逃避先天免疫监视——
对于具体的研究过程不再详述,主要探寻机制。在探究KRAS突变上调CD47表达的分子机制的过程中,研究团队首先发现CD47存在由miR-34a介导的转录后调控现象,接下来验证了KRAS突变对miR-34a的负调控作用,随后通过一系列的分子生物学和药理学实验,该课题组证明突变的KRAS通过激活PI3K-STAT3信号从而抑制miR-34a的表达,进而缓解miR-34a对CD47的转录后抑制作用,最终导致CD47在肺腺癌细胞中出现异常的高表达。
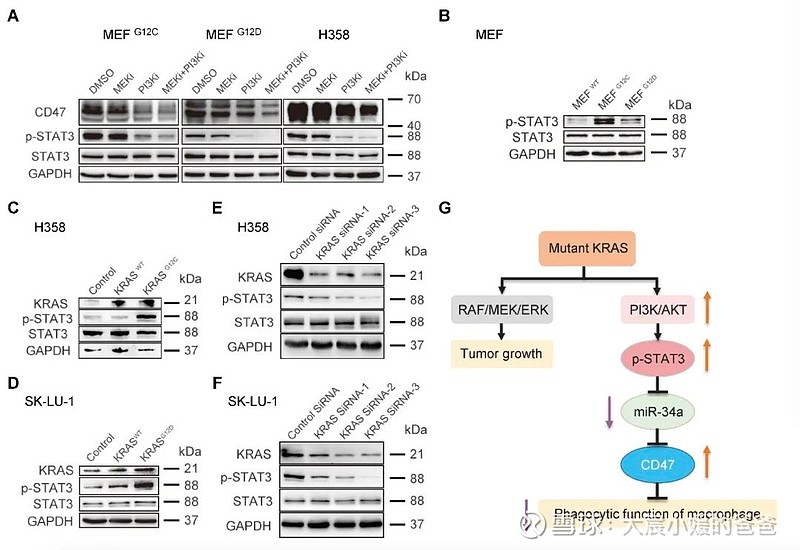
KRAS modulates CD47 expression through the PI3K-STAT3-miR-34a signaling axis
(A) MEK和PI3K抑制对MEF和H358细胞中CD47、p-STAT3和总STAT3表达的影响。(B-F)MEF中KRAS、p-STAT3和总STAT3表达水平的蛋白质印迹分析(B);H358细胞过度表达KRASWT或KRASG12C(C);SK-LU-1细胞过度表达KRASWT或KRASG12D(D);用三种KRAS siRNA转染的H358细胞(E);或用三种KRAS siRNA转染的SK-LU-1细胞(F)。(G) KRAS突变调节CD47表达和巨噬细胞吞噬功能的信号通路示意图。
解决了机制问题,就得再解决靶点成药性问题。期望在胰腺癌这种“癌王”领域能够有所突破。而突破的可能,绝不是单独的CD47抗体单用,必然是其他治疗手段联合探索,那放疗会否是一种好的联合方式呢?
——摘 要——
本文选自Nature Cancer期刊上的一篇综述,标题为《Radiotherapy in combination with CD47 blockade elicits a macrophage-mediated abscopal effect》,鉴于放疗也是肿瘤治疗的主要手段,但往往不能导致肿瘤细胞的完全清除。研究团队将放疗与CD47的“别吃我”信号阻断相联合,在高度转移性的小细胞肺癌临床前模型上进行机制探索。
之所以选择小细胞肺癌,是因为小细胞肺癌占所有肺癌的15%,每年导致全球超过200,000人死亡。既往,局晚期小细胞肺癌患者一直接受一线放疗联合化疗的治疗策略。初始治疗效果良好,但大多数患者复发率较高。近年来的研究方向之一是免疫检查点抑制剂与标准治疗相结合,有效提高了SCLC患者的总生存率。然而,总体治疗效果仍然有限,并且仍然需要开发更有效的治疗方法来增强T细胞或其他免疫细胞的活性。
CD47可与巨噬细胞上的SIRPα分子结合,给巨噬细胞传递“别吃我”信号,从而削弱巨噬细胞对肿瘤细胞的吞噬作用,并进一步影响抗原呈递和后续的抗肿瘤免疫反应。
CD47阻断可有效增强SCLC临床前模型放疗的局部抗肿瘤作用。值得注意的是,CD47阻断还刺激非靶向“远隔”效应,抑制接受辐射的小鼠中未经照射的SCLC肿瘤。这些远隔效应独立于T细胞,但需要巨噬细胞响应辐射产生的炎性信号迁移到未经辐射的肿瘤部位,并通过CD47阻断局部激活巨噬细胞以吞噬癌细胞。
在用放射和CD47阻断治疗的其他癌症模型中观察到类似的远隔抗肿瘤作用。放疗和CD47阻断后抗肿瘤巨噬细胞的全身活化可能对患有转移性疾病的癌症患者特别重要。
具体的研究图例如下:
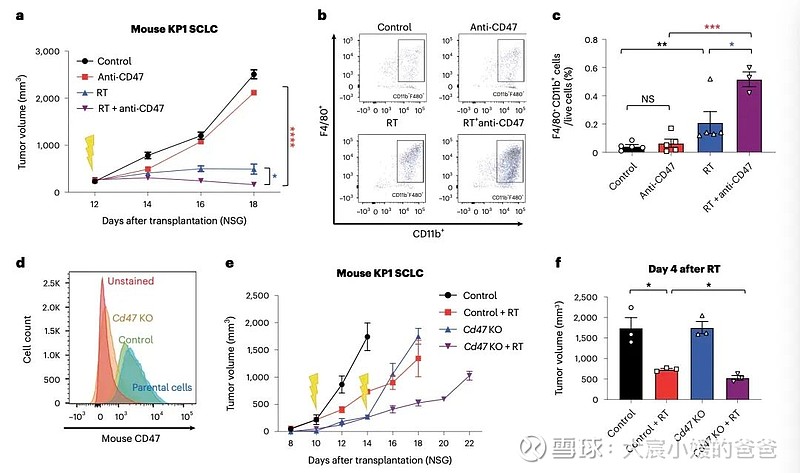
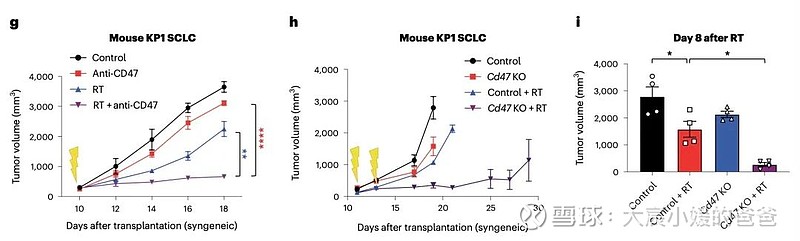
CD47阻断增强SCLC肿瘤放疗后局部肿瘤抑制
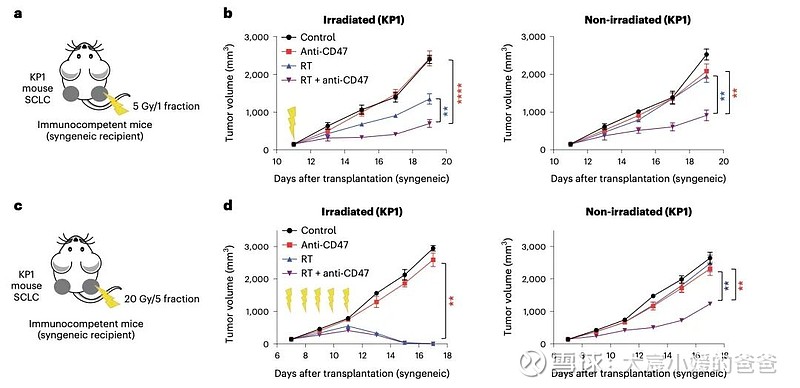
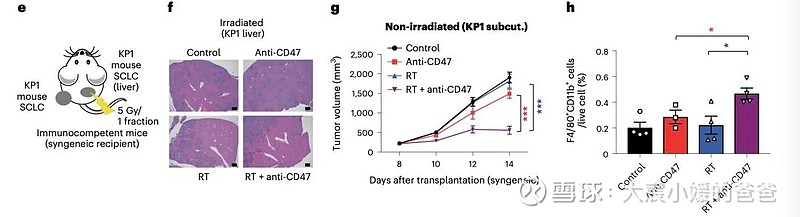
放疗和CD47阻断的组合导致SCLC临床前小鼠模型的远隔效应
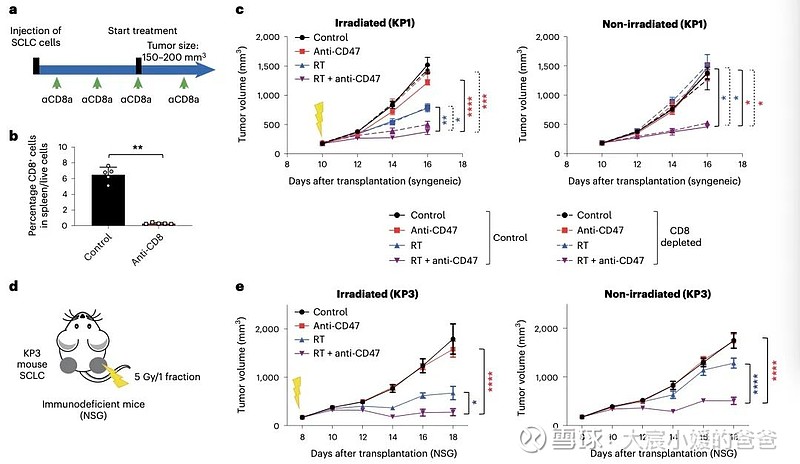
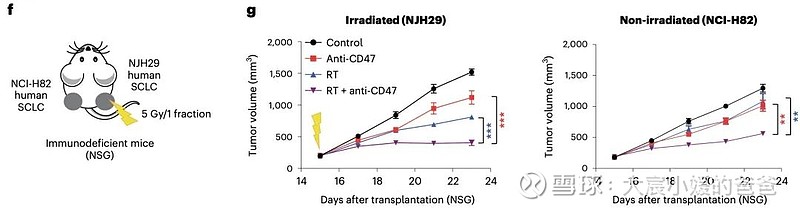
放疗和CD47阻断联合诱导的远隔效应与T细胞无关
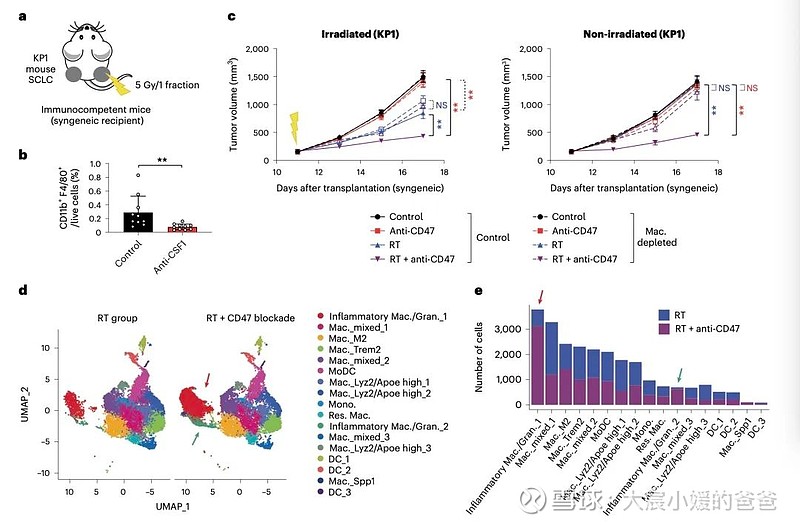
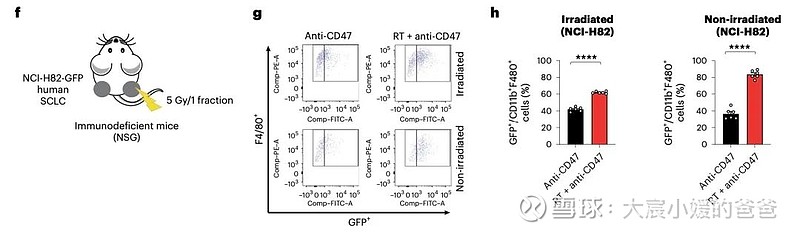
放疗联合抗CD47抗体诱导的远隔效应依赖于炎性巨噬细胞
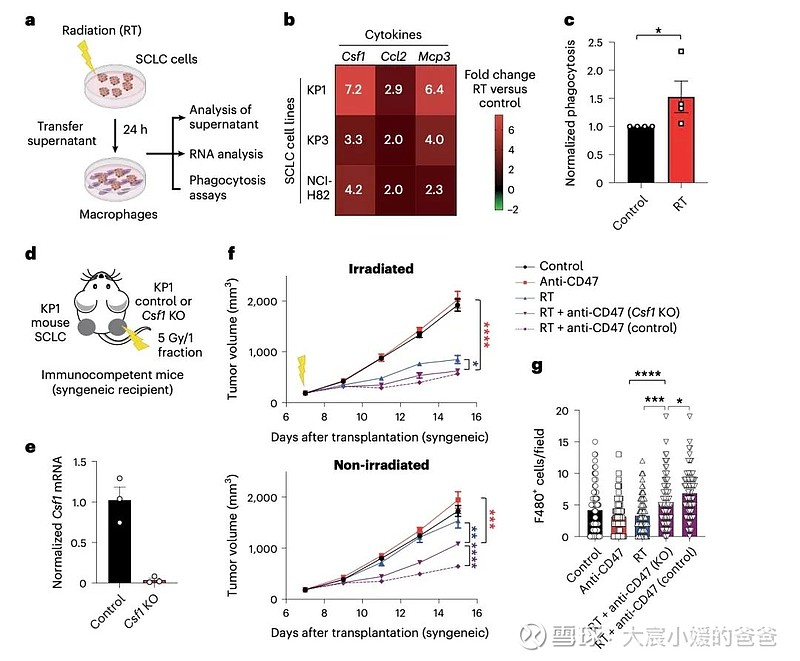
炎症巨噬细胞放疗后SCLC细胞产生的CSF1作出反应,以介导远隔反应
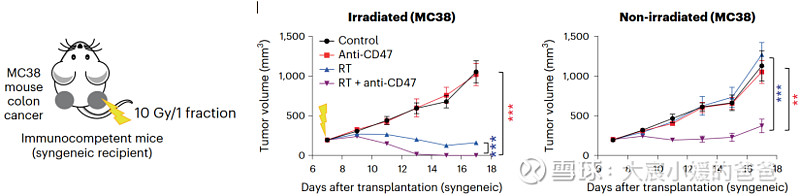
放疗联合抗CD47抗体可抑制结肠癌肿瘤生长并诱发远隔效应
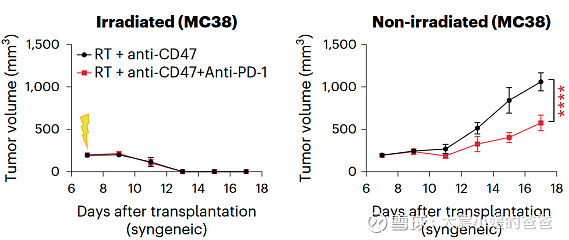
放疗联合抗CD47抗体及抗PD-1抗体,带来更强的肿瘤抑制效果
虽然放疗与抗CD47抗体的联合疗法诱导远隔效应不依赖T淋巴细胞,但是加入抗PD-1抗体后,激活的T淋巴细胞可能具有额外的抗肿瘤作用。
对SCLC肿瘤而言,将放疗与抗CD47抗体联合使用,可激活体内的巨噬细胞,在控制放疗侧肿瘤同时,还能引起系统性的免疫反应,诱导远隔效应的产生。期望能够由临床前模型的机制探索,通过转化医学,早日在小细胞肺癌患者中带来获益。
参考文献