创新药周报20221023:传奇Carvykti美国放量,看好CAR-T国际化机会
原创 华创-新药研究 2022-10-23 20:14 发表于广东
——————————————————————————————
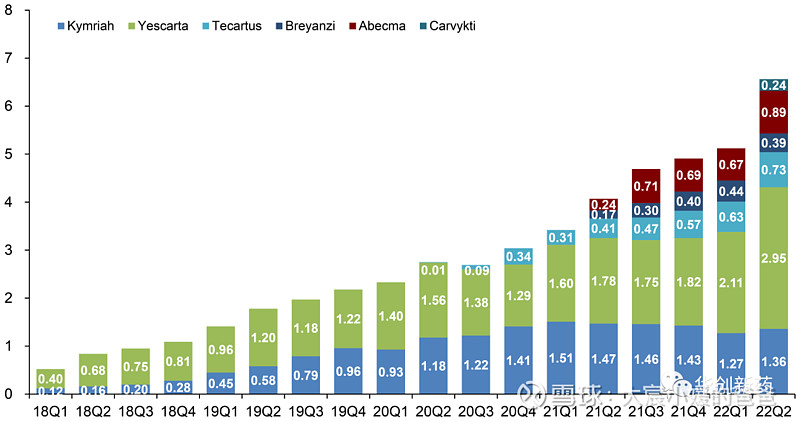
传奇Carvykti三季度销售额5500万美元,环比大幅增长
2022年10月19日,金斯瑞公布子公司传奇生物细胞治疗产品CARVYKTI 2022年第三季度销售额约为5500万美元,此前公布的第二季度销售额为2400万美元,环比增长129%。
CARVYKTI为全球第二款上市的BCMA CAR-T,于今年2月28日获得FDA批准,此后分别于5月和9月获批于欧洲和日本上市,用于治疗接受过四线及以上治疗(包括蛋白酶体抑制剂、免疫调节剂和抗CD38单克隆抗体)的复发/难治性多发性骨髓瘤患者。
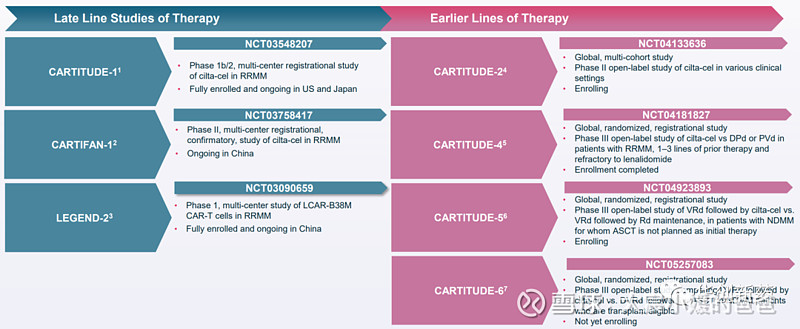
传奇生物和强生正在推进Carvykti用于前线治疗的临床研究,已经启动了一项临床II期研究CARTITUE-2,多队列探究早线治疗中Carvykti的疗效和安全性,并根据结果启动了三项全球多中心临床III期研究CARTITUDE-4、5、6。
CARTITUDE-2是一项全球多中心开放标签的多队列临床II期研究,共包含6个队列,入组了接受过不同情形早线治疗以及新确诊的患者,评估Carvykti的疗效与安全性。
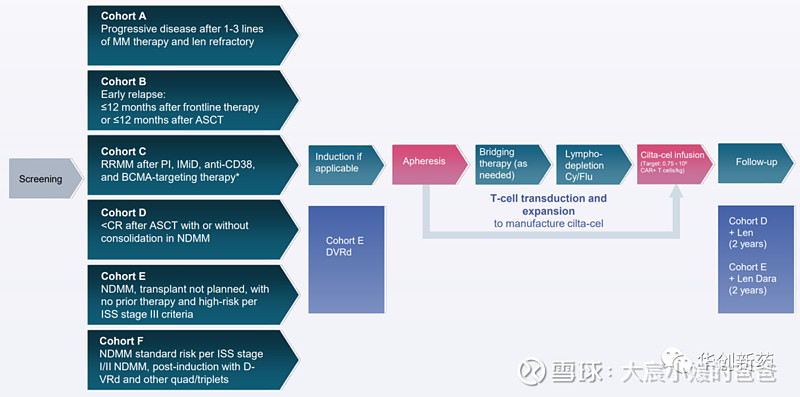
CARTITUDE-2队列A评估了Carvykti在既往接受过1-3线治疗,来那度胺复发的R/R MM患者中的疗效与安全性。中位随访时间为17.1个月时的数据显示,患者对Carvykti的响应随着时间的推移而加深,未达到中位DOR,首次响应时间中位数为1.0个月(范围,0.7–3.3),获得最佳响应的中位时间为2.6 个月(范围,0.9–13.6),15 个月PFS率为 70%(95% CI,45.1–85.3),所有16例获得可评估样本的患者均达到MRD阴性(10-5)。安全性整体可控,一名患者接受了门诊治疗。所有级别CRS发生率为95%,其中3级及以上为10%。所有级别神经毒性发生率为30%,其中3/4级为5%。共发生4例死亡。
CARTITUDE-2队列B评估了Carvykti对接受初始治疗(包括蛋白酶体抑制剂、免疫调节剂或ASCT)后12个月内复发的R/R MM患者中的疗效与安全性。中位随访时间为13.4个月时的数据显示,患者对Carvykti的响应随着时间的推移而加深,未达到中位DOR,首次响应时间中位数为1.0个月(范围,0.9-9.7),获得最佳响应的中位时间为5.1 个月(范围,0.9–11.8),12个月PFS率为89.5%(95% CI ,64.1-97.3),所有15例获得可评估样本的患者中93%达到MRD阴性(10-5)。安全性整体可控,一名患者接受了门诊治疗。所有级别CRS发生率为84%,其中3/4级为5%。所有级别神经毒性发生率为26%,其中3/4级为5%。共发生1例死亡。

基于这两个队列的积极数据,公司已启动全球多中心临床III期研究CARTITUDE-4,评估Carvykti在既往接受过1-3线治疗,来那度胺复发的R/R MM患者中的疗效与安全性,已经完成患者招募,有望于今年年底前公布初步数据。

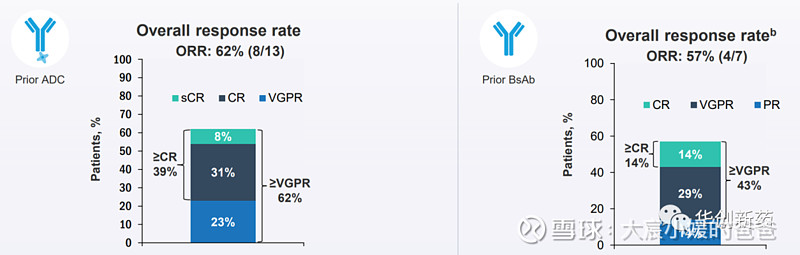
CARTITUDE-2队列C评估了Carvykti在既往接受过抗BCMA治疗R/R MM患者中的疗效与安全性。在入组的20例患者中,80%的患者对既往抗BCMA治疗无效。当中位随访时间为11.3 个月时,既往接受过ADC治疗(n =13)的患者ORR为62%;既往接受过BsAb治疗的患者(n = 7)ORR为57%。首次响应的中位数时间约为1个月。
安全性方面,12名患者发生CRS:发病中位时间为7.5天(2-10天),中位持续时间为7天(2-9天),所有患有CRS的患者都接受了1种及以上的治疗。4例患者发生ICANS:发病中位时间为9.0天(4-13天),中位持续时间为7.0天(4-20天),3例患者ICANS得到缓解,发生率(20%)与CARTITUDE-1相似(17%)。该队列中未观察到MNT/帕金森综合征病例。队列C共发生7例死亡(1例因治疗相关AE,3例因治疗无关的 AE,3例因疾病进展)。
传奇生物和强生还推进了两项在新确诊多发性骨髓瘤患者中开展的临床试验:
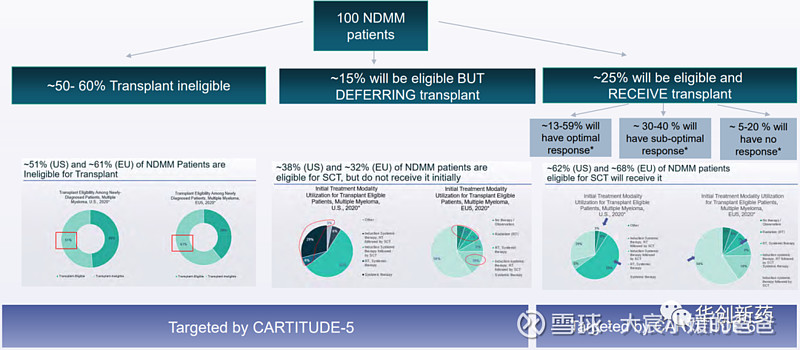
CARTITUDE-5招募了新确诊且无法进行骨髓干细胞移植的患者入组,患者由于高龄或者其他原因不适宜接受大剂量化疗和ASCT作为初始治疗。该临床试验已经启动,正在招募中。
CARTITUDE-6招募了新确诊且适用于骨髓干细胞移植的患者入组。该临床试验暂未开始患者招募,计划将在全球多个临床中心进行。
传奇生物和强生对Carvykti的前线临床推进和未来潜在的市场规模充满信心。从CARTITUDE-2的初步积极数据来看,针对接受过1-3线前线治疗的R/R MM患者开展的CARTITUDE-4成功的可能性较大,将进一步拓展适用患者人群。此外针对新确诊多发性骨髓瘤患者的CARTITUDE-5&6两项临床试验如果取得优效,有望改变多发性骨髓瘤的治疗范式。据强生预测,Carvykti峰值销售将达到50亿美元,市场潜力巨大。
科济药业:泽沃基奥仑赛NDA获受理并纳入优先审评
2022年10月18日,科济药业宣布BCMA CAR-T泽沃基奥仑赛注射液(zevorcabtagene autoleucel,CT053)的新药上市申请(NDA)已获得NMPA受理并纳入优先审评,用于治疗复发/难治多发性骨髓瘤。该疗法此前已于2020年获得国家药品监督管理局的突破性治疗药物品种认定。
2022年9月21日,科济药业在第七届CAR-TCR年度峰会上,口头介绍了泽沃基奥仑赛注射液北美2期临床试验的最新数据。该项多中心、开放标签的1b/2期试验正在进行,以评估在北美复发/难治多发性骨髓瘤(R/R MM)患者中的安全性和有效性。截至2022年8月31日,17名复发/难治多发性骨髓瘤患者在2期临床试验中接受zevor-cel输注,且中位随访时间113天(范围:9到373)。在这17名患者中,5(29.4%)名患者伴随髓外病变(EMD;≥1个浆细胞瘤),以及9(52.9%)名患者具有高危细胞遗传学特征。患者既往接受过多线治疗,中位治疗线数为6(范围:4到17)。所有患者在接受过他们的最后一线治疗后均无效。在接受zevor-cel输注前,患者接受的清淋方案为连续3天的氟达拉滨30mg/m2和连续2天的环磷酰胺500mg/m2。
有效性方面,在11名至少8周随访的可评估的患者中,4例患者伴随EMD,11例患者客观缓解率为100% (非常好的部分缓解、完全缓解或严格完全缓解),并在更长时间的随访观察到更深的缓解。由于所有的缓解都在进行中,中位无进展生存期、中位生存期和中位缓解持续时间尚未达到,并且完全缓解/严格完全缓解率尚未成熟。所有的在第四周有MRD结果的患者,通过二代测序MRD均为阴性。
安全性方面,没有出现死亡,以及没有患者经历过3级或者更高的细胞因子释放综合征。在10/17(59%)名患者中观察到细胞因子释放综合征,均为1级或者2级。有一例短暂的3级免疫效应细胞相关神经毒性综合征被报导且该病人已完全恢复;没有神经毒性且没有观察到具有帕金森特征。在毒性的处理方面,仅5/17(29%)名患者接受托珠单抗治疗,仅1名(5.9%)患者接受糖皮质激素治疗。值得注意的是,在这项研究中,有3名患者接受了zevor-cel门诊治疗且其中两名患者因为症状管理入院一到两天。
