消化道癌症热门靶点Claudin 18.2 | 全球临床管线盘点
来源:药明康德 2022-05-23 A- A+
5月9日,科济药业靶向CLDN18.2(Claudin18.2)的CAR-T细胞候选产品CT041的1期期中分析结果发表在Nature Medicine上,CT041针对适应症为CLDN18.2阳性晚期消化道肿瘤,目前确证性2期临床试验已经启动。这一最新临床试验数据的发布也受到了业内极大关注。CLDN18.2是近年来治疗实体瘤的热门靶点。在这篇文章里,药明康德内容团队将介绍关于这个靶点的信息和在研管线。
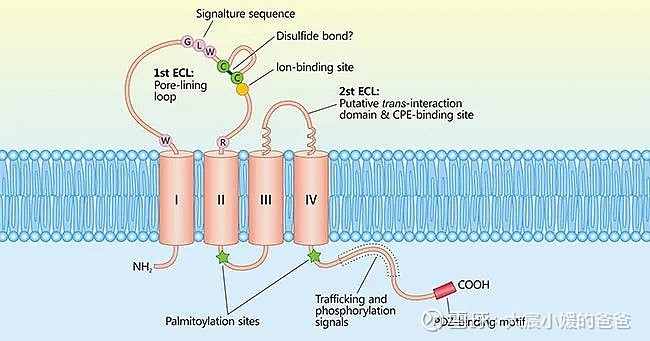
▲Claudin蛋白结构(图片来源:参考资料[8])
揭秘CLDN18.2:抗击实体瘤 “新宠”
CLDN(Claudin)是正常组织紧密连接中重要的一种蛋白质,具有4个跨膜结构域,CLDN的功能是参与细胞旁通透性和电导等过程的调节。1998年,日本科学家Shoichiro Tsukita博士及其同事最早发现CLDN。CLDN家族包含至少27个成员,其中CLDN18有CLDN18.1和CLDN18.2两种异构体。
2008年,Ganymed公司的创始人、癌症免疫疗法专家Ugur Sahin博士等人发现,在正常生理状态下,CLDN18.2仅在胃粘膜上已分化的上皮细胞中表达,而在其它的健康组织中均无表达。但在胃癌、食管癌、胰腺癌、肺癌、卵巢癌、结肠癌等多种肿瘤中,CLDN18.2却呈现高表达的现象。因此,CLDN18.2有可能成为胃癌、胰腺癌等实体肿瘤免疫治疗的有效靶标。
虽然CLDN18.2在实体瘤靶向疗法开发领域具有潜力,但是这一领域的发展进展一直比较缓慢。2016年,Ganymed公司在美国临床肿瘤学会(ASCO)年会上公布了其CLDN18.2靶向单抗zolbetuximab的2b期临床试验结果,以黑马之姿成为当年ASCO年会的最大亮点之一。CLDN18.2这个抗癌靶点也引起了业界广泛的关注。安斯泰来当年以14亿美元收购Ganymed公司,囊获了其核心资产zolbetuximab(曾用名:IMAB362),zolbetuximab也是全球最早进入3期临床研究的靶向CLDN18.2疗法。值得一提的是,Ugur Sahin博士夫妇也是BioNTech公司的创始人。
自CLDN18.2引起关注后,许多公司争相进行靶向CLDN18.2的药物布局。总体而言,大部分CLDN18.2靶向在研药物还处于早期开发阶段。
临床阶段在研疗法概述:多种治疗模式
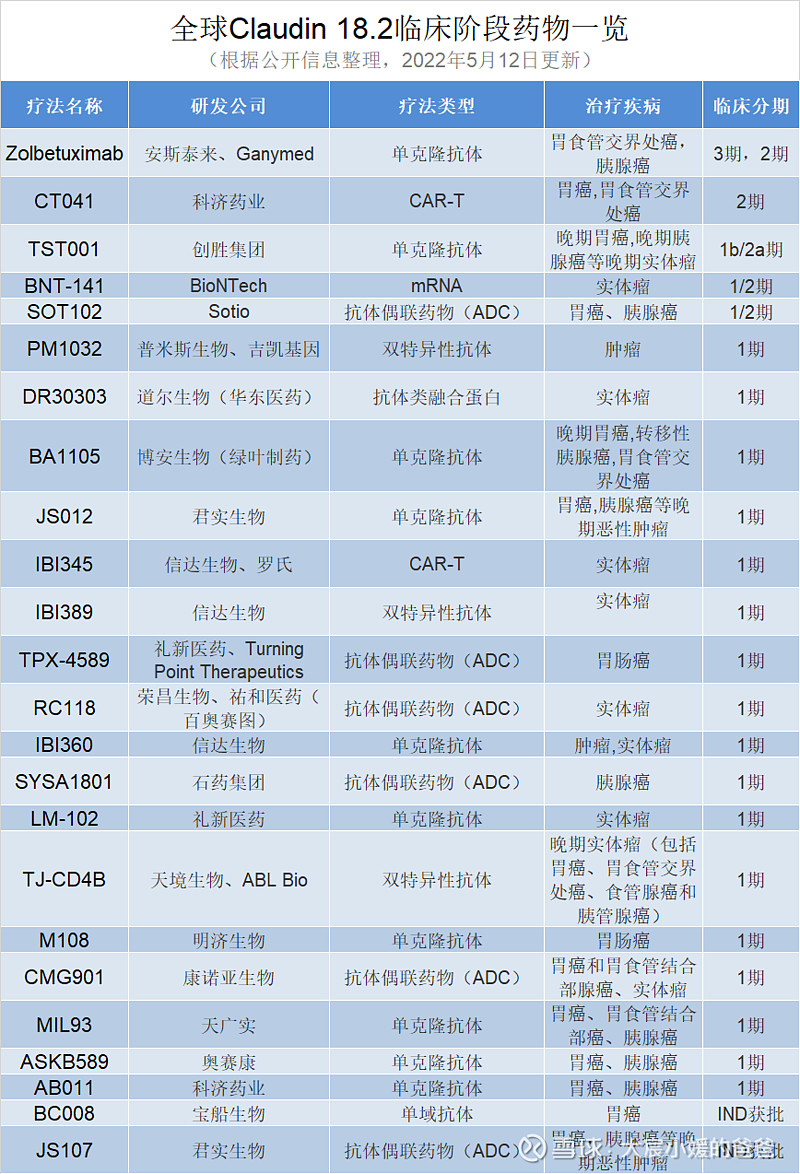
据不完全统计,目前全球范围内共有24款靶向CLDN18.2的疗法正处于临床开发阶段(包括2款IND申请获批的疗法)。
其中已进入2期、3期临床阶段的疗法有2种,分别是安斯泰来的zolbetuximab以及科济药业的CT-041。
处于1/2期临床阶段的疗法有3种,创胜的TST001、BioNTech的BNT-141和Sotio的SOT102。
17种疗法正进行1期临床试验,值得注意的是这些疗法大多由中国公司开发,信达生物、礼新医药、君实生物更是有多款药物上榜,由此可见中国药企在CLDN18.2这一靶点上的积极布局。另外近日礼新医药以2500万美元首付款、超10亿美元的潜在总金额将LM-302在大中华区和韩国以外的全球开发及商业化权益授权给Turning Point Therapeutics。
作为热门靶点,针对CLDN18.2的在研临床疗法取得的进展备受关注,下面我们首先从临床进度较快的两款疗法zolbetuximab和CT-041说起。
Zolbetuximab是一种IgG1单克隆抗体,在肿瘤细胞表面与CLDN18.2特异结合,从而引发抗体依赖性细胞毒性(ADCC)、补体依赖性细胞毒性(CDC),凋亡和抑制肿瘤细胞增殖。
Zolbetuximab在一项2期临床试验中与一线化疗联用,能够改善CLDN18.2阳性患者的无进展生存期和总生存期(OS)。目前,该疗法正在一项3期临床试验中,评估其对CLDN18.2阳性、转移性或晚期不可切除胃和食管胃结合部腺癌患者疗效。此外,评估zolbetuximab联合白蛋白结合型紫杉醇和吉西他滨作为CLDN18.2阳性转移性胰腺癌患者一线治疗的疗效和安全性的研究也正在开展。
CT041是一款靶向CLDN18.2的自体CAR-T细胞候选产品。此前,CT041已经获得FDA授予的再生医学先进疗法(RMAT)资格,用于治疗CLDN18.2阳性的晚期胃癌/食管胃结合部腺癌;获欧洲药品管理局(EMA)授予优先药物(PRIME)资格,用于治疗晚期胃癌。
本文开头提到的发表在Nature Medicine上的研究是一项在中国开展、多中心、开放标签的1期临床试验,评估CT041治疗CLDN18.2阳性的晚期消化系统肿瘤患者的安全性、有效性和细胞代谢动力学。结果显示,在37例晚期消化系统肿瘤患者中,CT041整体耐受性良好且安全性风险可控。CT041在消化系统肿瘤患者中的客观缓解率(ORR)和疾病控制率(DCR)分别为48.6%和73.0%,在胃癌患者中的ORR和DCR分别达到57.1%和75.0%。
针对CT041,科济药业在中国开展了研究者发起的临床试验、针对晚期胃癌/食管胃结合部腺癌和胰腺癌的1b期临床试验、针对晚期胃癌/食管胃结合部腺癌的确证性2期临床试验,以及在北美启动了一项针对晚期胃癌或胰腺癌的1b期临床试验,计划于今年在北美启动关键2期临床试验。
而22款处于1期及IND的临床治疗药物中,单克隆抗体数量最多,有9款;第二位为抗体偶联药物,有6款。同时也有特殊类型的如mRNA、CAR-T细胞疗法、单域抗体以及融合蛋白的出现。适应症集中在胃、胰腺等消化道的实体瘤,其中适应症为胃癌的药物有11款,适应症为胰腺癌的药物有10款。
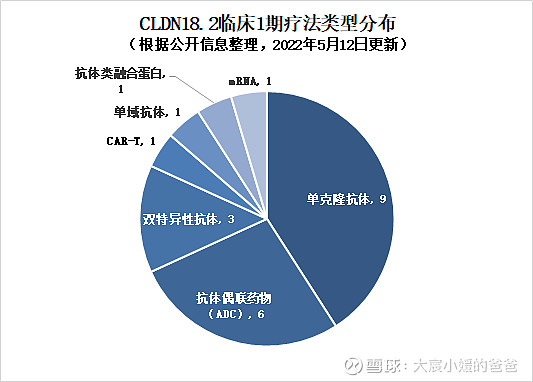
▲CLDN18.2临床1期疗法类型分布(药明康德内容团队制图,点击可见大图)
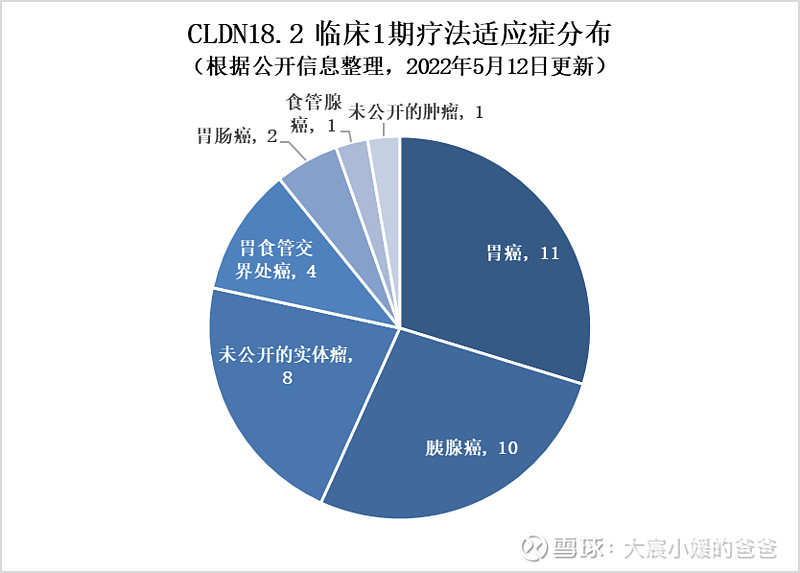
▲CLDN18.2临床1期疗法适应症分布(药明康德内容团队制图,点击可见大图)
已经进入临床1/2期的疗法有三款,分别为创胜集团的单克隆抗体TST001,BioNTech的mRNA疗法BNT-141以及Sotio的抗体偶联药物SOT102。其中,值得一提的是目前全球管线中潜在的唯一一款mRNA疗法,BioTech的BNT-141使用了核苷修饰的mRNA设计用于减少免疫原性,以避免免疫反应,并且可以在细胞当中翻译生成靶向CLDN18.2的抗体。该疗法使用靶向肝脏的脂质纳米颗粒(LNP)递送技术,采用静脉给药方式,以确保抗体的全身可用性,延长编码抗体在体内的作用时间。