去甲肾上腺素(Norepinephrine,NE)是一类外周和中枢神经系统的神经递质,主要由交感节后神经元和脑内去甲肾上腺素能神经元合成和分泌。在中枢神经系统中,蓝斑(locus coeruleus,LC)是合成去甲肾上腺素的主要部位,主要由 LC 中的 NE 能神经元负责合成产生 NE。
NE 能神经元在整个大脑和脊髓中广泛投射。大量研究表明,NE 能神经元与多种精神疾病以及神经退行性疾病的发生和发展密切相关,已成为开发新兴药物的明星靶点之一。然而,现阶段合成现成的人 NE 能神经元尚未实现。
近期,威斯康星大学麦迪逊分校的研究人员发现了一种对 NE 能神经元分化过程中起关键作用的转录因子,并首次基于这一发现将人多能干细胞(hPSC)诱导分化为 NE 能神经元。相关研究已经发表在 Nature Biotechnology 上。
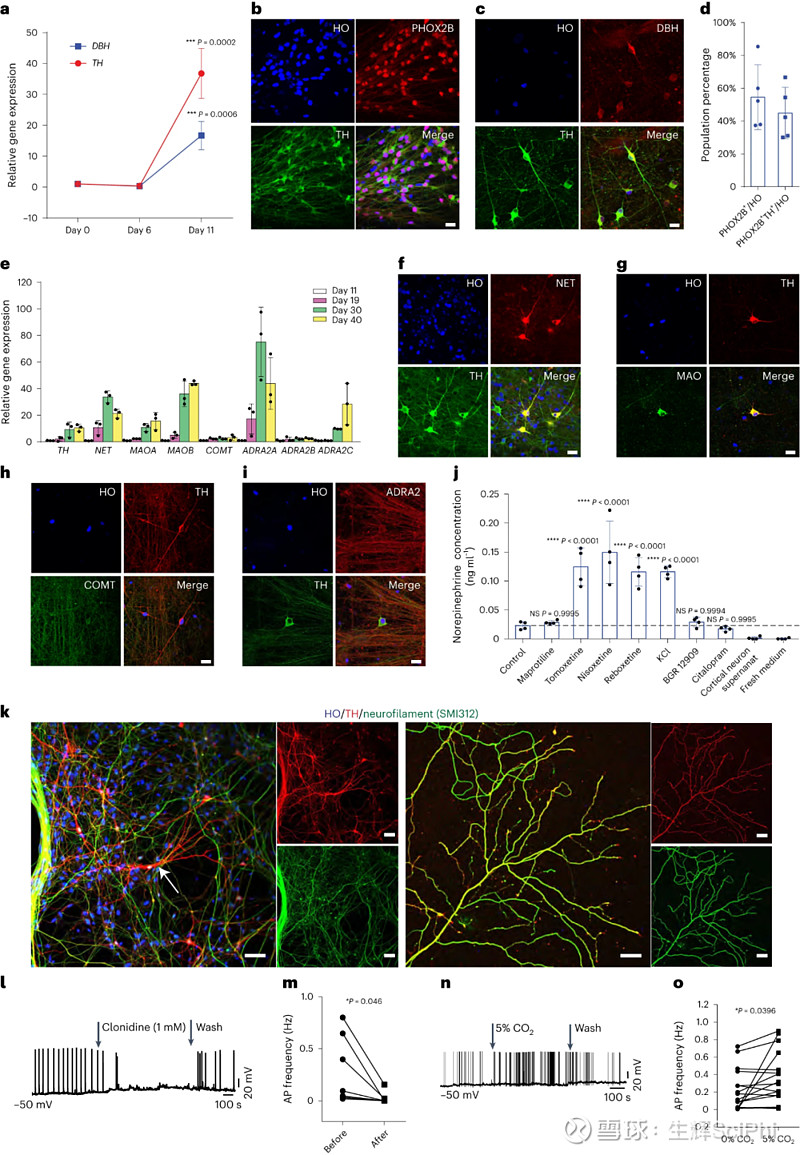
具体来说,在试验中,研究人员发现转录因子 ACTIVIN A 在调节背侧菱形体 1(r1)前体细胞分化为 LC-NE 能神经元过程中的关键作用。基于这一发现,他们开发出了一种把人多能干细胞诱导分化成中枢 NE 能神经元的方法,分化效率为 40%-60%,并将分化培养出的神经元称之为 LC-NE 能神经元。

点击输入图片描述(最多30字)
(来源:Nature Biotechnology)
在研究中,体外生成的人 LC-NE 能神经元与体内对应的神经元相似,表现出大量的轴突树枝状,分泌和摄取 NE,且具有化学感受器活性。
论文中还提到,人多能干细胞衍生的 LC-NE 能神经元有助于进一步推进许多精神疾病和神经退行性疾病的基础研究,并为开发新治疗方法提供了工具。
本文的通讯作者是威斯康星大学麦迪逊分校干细胞与再生医学中心的神经科学和神经病学教授 Su-Chun Zhang(张素春),论文的第一作者兼通讯作者是 Yunlong Tao(陶云龙)。Yunlong Tao 现在是南京大学生命科学学院及化学和生物医药创新研究院双聘课题组长,博士生导师,他曾在张素春实验室从事博士后研究并担任研究助理教授。
张素春是干细胞领域的先驱性人物。他是全球首个基于胚胎干细胞诱导培育出神经元的科学家,这一进展为干细胞分化为各种不同类型的神经元提供了可能性。2005 年,他实验室在全球首次成功利用人干细胞分化培育出了运动神经元。他实验室的研究方向是人干细胞和神经再生,重点研究人类神经上皮细胞如何被分化为神经元和神经胶质细胞。
分化效率最高达 60%,具有功能性特征
蓝斑位于第四脑室底,脑桥前背部,大约有 50,000 个 LC-NE 能神经元。在新闻稿中,Su-Chun Zhang 指出这些细胞对人类的生命活动至关重要,并将此类细胞称之为“生命中心”。
此前的研究已经证明这些神经元在多种神经退行性疾病和神经精神疾病中发挥作用,但是具体的作用机制并不完全清晰。不过,研究人员从一些试验中发现了一些线索,在阿尔茨海默氏症和帕金森氏症疾病中,蓝斑中的神经元在很早的阶段开始出现退化,甚至有时候比其他脑区的退化时间还要提早几年。
论文一作陶云龙表示,科学家们很早之前就注意到了这一点,但是仍不清楚蓝斑在这个过程中的作用。部分原因是没有一个合适的模型模拟人 LC-NE 能神经元。
此前,基于人诱导多能干细胞分化 LC-NE 能神经元基于小鼠模型中 LC-NE 能神经元发育的方法。但是,干细胞发育为 NE 能神经元的分化途径存在物种差异,因此尚不明确人 NE 能神经元尤其是 LC-NE 能神经元的分化路径。
在此背景下,陶云龙在张素春实验室探索了此前方法失败的原因,以及分析了人多能干细胞分化发育成的神经元的不同之处。在最新的研究中,陶云龙发现转录因子 ACTIVIN-A 在调节人多能干细胞分化为 NE 能神经元的过程中发挥了重要的作用。ACTIVIN-A 是一种转化生长因子,也称之为活化素或者激活素,可控制胚胎轴发育为有功能的前肠源性组织,其调节多种细胞的生长和分化。

点击输入图片描述(最多30字)
▲图 | 左为第一兼通讯作者,右为通讯作者(来源:威斯康星大学麦迪逊分校)
具体来说,LC-NE 能神经元起源于胚胎发育期间的背侧菱形体 1(r1)前体细胞。研究人员首先利用 BMP 受体抑制剂 DMH1 和 TGFβ 受体抑制剂 SB431542 将人胚胎干细胞分化为神经上皮细胞,在第 6 天发现超过 80% 的神经上皮细胞为 PAX7 阳性(LC-NE 能神经元大部分前体细胞来自小鼠 PAX7+细胞系),表明这些分化的细胞来自于r1谱系。
接下来,他们通过试验证明了 ACTIVIN A 在 hPSC 衍生 NE 能神经元的前体细胞中发挥特殊作用,且 ACTIVIN A 特异性作用于 r1 前体细胞,从而使人多能干细胞生成 NE 能神经元的前体细胞。
进一步的研究表明,与小鼠细胞相反,许多 BMP 家族配体负向调节 hPSC 分化产生 NE 能神经元的前体细胞。且 BMP 会抑制源自人 r1 前体细胞谱系的 NE 能神经元前体细胞的命运,抑制 BMP 可进一步提高了 ACTIVIN A 调节 NE 能神经元前体细胞的作用。
研究人员在新闻稿中表示,“通过研究我们对蓝斑的发育有了一些新认知,然后基于这些新发现生成 LC-NE 能神经元。”随后,他们将人多能干细胞转化为 NE 能神经元d的前体细胞,并利用 ACTIVIN-A 等调节因子引导 NE 能神经元的前体细胞分化发育为 LC-NE 能神经元,分化的效率在 40%-60% 区间。
hPSC 衍生的 LC-NE 能神经元表现出了类似人脑中功能性 LC-NE 能神经元的典型特征,可以释放和摄取去甲肾上腺素;且经过长期分化(持续 2 个月),NE 能神经元发育出了大量的轴突分支。
点击输入图片描述(最多30字)
▲图 | NE 能神经元的成熟(来源:上述论文)
接下来,研究人员测试了 NE 能神经元的电生理特征,在小鼠试验中,hPSC 衍生的 LC-NE 能神经元在高碳酸血症(高浓度 CO2)环境下会增加放电频率,这表明这些细胞具有化学感受器活性,化学感受器对于控制呼吸至关重要。
可用于药物筛选、干细胞治疗
谈及应用潜力,张素春在新闻稿中表示,这些 hPSC 衍生的 LC-NE 能神经元可以用于探索蓝斑中的神经元在神经退行性疾病中较早死亡等基础问题,也可以作为多种神经退行性疾病和神经精神疾病的模型,帮助科学家筛选潜在治疗药物。
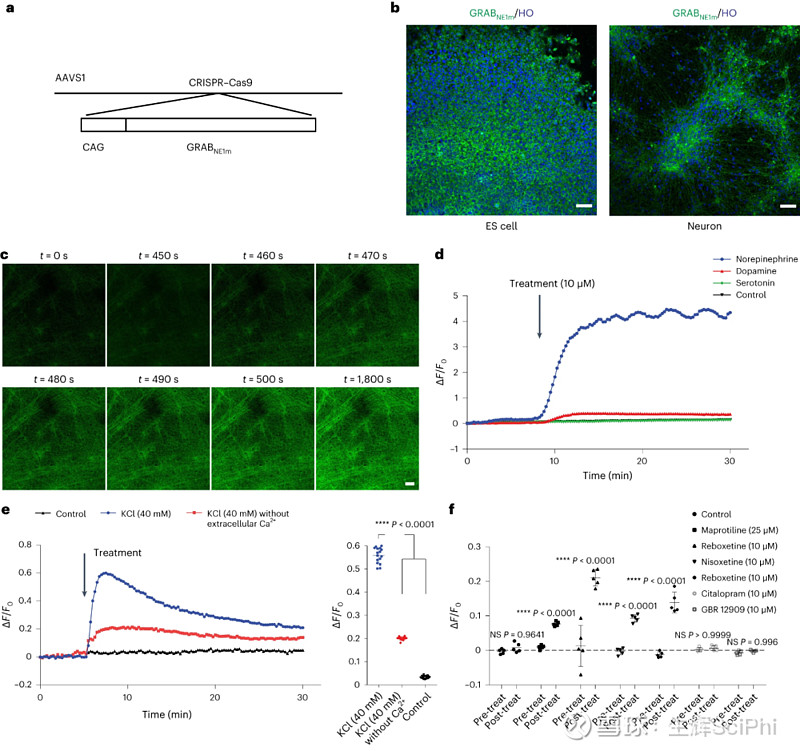
在试验中,研究人员通过利用 CRISPR/Cas9 设计了 H9 细胞系,并在 AAVS1 位点插入 GRABNE1m 传感器,检测细胞外 NE 水平。试验结果表明,GRABNE1m 可以感知神经元活动依赖性 NE 释放/摄取。
随后,研究人员通过四种 NE 再摄取抑制剂(NRI)托莫西汀、马普替林、瑞波西汀和尼索西汀验证了表达 NE 能神经元的 GRABNE1m 传感器在药物测试中的效果,该传感器有潜力助力筛选调节 NE 释放和摄取的新药物。
点击输入图片描述(最多30字)
▲图 | NE 传感器的生成和测试(来源:上述论文)
据悉,接下来,研究人员计划进一步分析 ACTIVIN-A 调节 LC-NE 能神经元发育的详细机制,还计划利用这些 hPSC 衍生的 LC-NE 能神经元进行药物筛选和疾病建模等转化工作。
张素春还表示,“LC-NE 能神经元未来有望用作干细胞疗法,用于神经退行性疾病和神经精神疾病治疗,总之这类细胞具有广泛的应用意义。
值得一提的是,张素春联合创办的干细胞公司 BrainXell inc. 一直在推进其实验室研究成果的转化工作。这家公司成立于 2015 年,位于威斯康星州麦迪逊,拥有多项基于人类干细胞定向分化为高度富集的神经元亚型的专有技术。该公司的重点是药物发现,可提供一系列高纯度、iPSC 衍生的人类神经元。与此同时,该公司也在推进用于帕金森病、脊髓损伤等适应症的干细胞治疗,其中用于帕金森病的干细胞治疗管线处于临床前研究阶段。
免责声明:本文旨在传递生命科学和医疗健康产业最新讯息,不代表平台立场,不构成任何投资意见和建议,以官方/公司公告为准。本文也不是治疗方案推荐,如需获得治疗方案指导,请前往正规医院就诊。
素材来源官方媒体/网络新闻