

正文共:1596字 1图
预计阅读时间:4分钟
2023年,辉瑞相继终止了两款GLP-1口服小分子激动剂,Lotiglipron和danuglipron(一日两次)的临床开发。
失意后的辉瑞,决定再试一次。
2024年7月11日,辉瑞宣布基于目前正在进行的1期药代动力学研究结果,确定推进其剂型改良版danuglipron(一日一次)。

该研究旨在探索原剂型danuglipron与三种改良剂型danuglipron(不同剂量/释放速率)单次给药后的PK和安全性。
结果支持每日一次给药的药代动力学特征,其安全性与之前的danuglipron研究一致,在超过1400名研究参与者中未观察到肝酶升高。
因此,辉瑞计划将于2024年下半年启动该剂型改良版danuglipron的剂量优化研究,以评估多个剂量的疗效和安全性。
受消息面影响,辉瑞股价盘初上涨了3.1%,截止收盘涨幅为1.09%。与之对应,礼来与诺和诺德股价相应下跌。(非主要影响因素)
01
GLP-1的火热,不言而喻。根据辉瑞的预计,减肥药市场将在未来十年内增长至约1300亿美元,而口服药片有望占据该市场的约三分之一。
如此一大块蛋糕,谁都无法割舍。有行业人士笑称“PD-1洗澡,GLP-1游泳”,无论Biotech,还是MNC,管线中多少都要有一个GLP-1项目。
辉瑞也不例外,但其研发进程并不顺利。
2023年6月,辉瑞宣布终止每日一次Lotiglipron的临床开发,根据其药代动力学数据,治疗组人群出现了转氨酶升高的情况,这是一种肝细胞受损的信号。
而这,还只是刚刚开始。2023年12月,辉瑞再次宣布,终止其另一款口服GLP-1小分子激动剂danuglipron(一日两次)的临床开发,原因还是安全性问题。
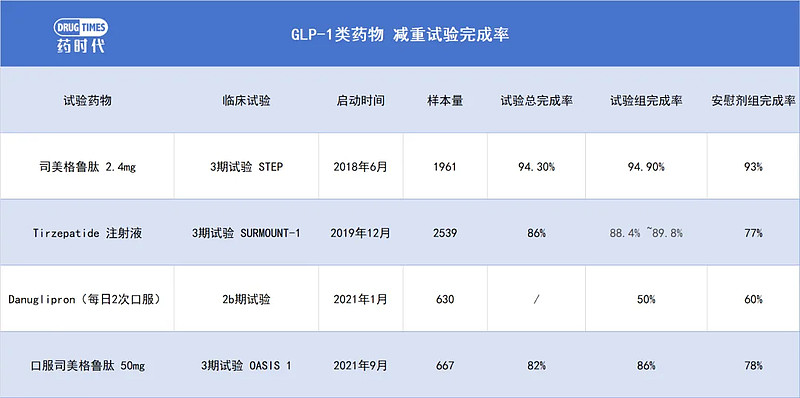
在其针对肥胖症的IIb期研究中,治疗组胃肠道反应发生率(恶心73%,呕吐47%,腹泻25%)较高,且在不同剂量下的停药率均超过50%,远高于安慰剂组约40%的比例,表明该药物在部分患者中的耐受性较差。
如今,辉瑞虽然决定“复活”了danuglipron,并推出QD改良版,但能否解决安全性问题?仍是未知。
02
目前,在辉瑞的临床管线中,有三款肥胖/糖尿病候选产品。除danuglipron之外,还有另一款口服GLP-1受体激动剂PF-06954522,尚处在临床1期。
至于另一款PF-07976016,靶点并未披露,同样处在临床1期阶段。
如此临床进展,无疑落后竞品太多。即便,辉瑞成功在不牺牲danuglipron既往疗效的情况下,解决了安全性问题,市场还会给机会吗?
截止目前,司美格鲁肽口服版Rybelsus虽仍是全球唯一上市的口服GLP-1RA,但礼来的小分子GLP-1R激动剂Orforglipron也紧跟其后,且与danuglipron一样,同为每日1次口服片剂,目前处在III期阶段。
不少MNC,更是选择直接摘果,如罗氏收购Carmot Therapeutics快速实现口服GLP-1RA的布局。
至于国内,硕迪生物的GSBR-1290;恒瑞的HRS-7535、信立泰的SAL0112等众多口服GLP-1RA的临床进度均超过了辉瑞的danuglipron改良版。
未来,辉瑞能否“蹭上蛋糕上的奶油”,拭目以待。
封面图来源:pixabay
