

正文共:2915字 4图
预计阅读时间:10分钟
2024年5 月 21 日,礼来的替尔泊肽注射液(商品名:穆峰达 ®)获NMPA批准上市,用来改善接受二甲双胍和/或磺脲类药物治疗血糖仍控制不佳的成人2型糖尿病(T2DM)患者。
替尔泊肽由礼来自主研发,是全球首款GLP-1/GIP双靶点受体激动剂,为每周一次皮下注射,早先已被FDA批准降糖和减重两大适应症。
此次,替尔泊肽在国内获批上市,周制剂降糖药队伍又添一员猛将。
此前,NMPA已经批准包括司美格鲁肽注射液(诺和泰®,诺和诺德)、注射用艾塞那肽微球(百达扬,三生制药)、度拉糖肽注射液(度易达, 礼来)、聚乙二醇洛塞那肽注射液(孚来美,豪森药业)、琥珀酸曲格列汀片(DPP-4抑制剂,科伦药业)等在内的周制剂降糖药。
从上述产品不难看出,大部分周制剂降糖产品仍是GLP-1类药物。
近年来,市场对GLP-1类产品的热情难止,原因在于其表现出的在降糖、减重、心血管疾病及其他一系列慢性疾病或精神类疾病中的积极信号。但是如果单论降糖,GLP-1类药物的整体实力还是不及胰岛素。
01 胰岛素:最直接,最有效的降糖方式
首先,从降糖机制上来讲,GLP-1(胰高血糖素样肽-1)是由肠道L细胞分泌的一种激素,主要通过促进胰岛素分泌、抑制胰高血糖素释放、减缓胃排空和减少食欲等方式达到降低血糖的功效。目前全球范围内上市的GLP-1RA类降糖药主要采用皮下注射和口服两种给药方式。
而胰岛素则属于简单粗暴的“直接派”,一般是通过注射(主要是皮下注射,也有特殊情况可采用肌肉/静脉注射)的方式,补充或替代患者体内缺失的胰岛素,直接调节血糖水平。
相比之下,胰岛素的适用范围更广,是需要严格控制血糖的1型糖尿病患者以及部分重度2型糖尿病患者的第一选择。尤其是对于本身不能正常分泌胰岛素的1型糖尿病(T1DM)患者而言,其日常的血糖控制通常采用每日多次注射或使用胰岛素泵的方式。
事实上,目前获批的GLP-1RA类降糖药也主要被被批准用于T2DM患者。但也有研究表明,对于仍残留有部分β细胞功能的T1DM患者,GLP-1RA联合胰岛素可能有望实现更理想的血糖控制。从理论上讲,GLP-1RA之于T1DM患者虽有可能辅助改善血糖控制,但并不能完全替代胰岛素治疗。
此外,并非所有T2DM患者均能使用GLP-1类药物。除了一般的过敏情况,包括糖尿病酮症酸中毒患者、有甲状腺髓样癌病史或家族史的患者,以及一些患有消耗性疾病(结核、肿瘤等)的患者均不能使用GLP-1类药物。对于上述这类患者,GLP-1RA的使用或将带来其他风险,胰岛素仍是最有效的选择。
再者,个体差异决定了一部分人需要更精细的血糖管理,比如对于需要餐时剂量调整或面临复杂血糖波动的患者,相比于GLP-1RA,胰岛素能提供更加灵活和精准的治疗方案。
02 礼来公布III期临床积极数据
据悉,胰岛素周制剂的应用预计为患者每年减少胰岛素注射约300余次,将使患者依从性大大改善。
但目前全球范围内尚未有胰岛素周制剂产品获批上市。
在礼来的替尔泊肽国内上市之前,这家公司还公布另一个值得关注的消息——胰岛素周制剂efsitora alfa(efsitora)在两项III期研究(QWINT-2和QWINT-4)中均达到主要终点。
QWINT-2(NCT05362058)研究共入组928名未经胰岛素治疗的T2DM成人患者。试验中,受试者被随机分配到美国、巴西、加拿大、中国、捷克共和国、德国、希腊、日本、韩国、墨西哥和波多黎。其中,试验组每周一次注射efsitora,对照组每日一次注射德谷胰岛素(诺和诺德)。
试验的主要终点是,52周时efsitora降低糖化血红蛋白(A1C,可反映过去2-3个月内患者平均血糖控制的情况,一般要求数值在7%或更低)的效果不亚于德谷胰岛素。且试验中纳入了部分使用GLP-1类药物的患者,因此也将评估efsitora在这部分患者中的治疗效果。
结果显示,52周时,efsitora降低了1.34%的A1C(6.87%<7%),德谷胰岛素降低了1.26%的A1C(6.95%<7%)。且针对使用/不使用GLP-1类药物的患者,efsitora表现出并不逊色于德谷胰岛素的降低A1C的能力。
QWINT-4(NCT05462756)研究共入组730名此前已接受基础胰岛素治疗且每天至少两次餐时胰岛素注射的T2DM成人患者。试验中,受试者被随机分配到美国、阿根廷、德国、印度、意大利、墨西哥、波多黎各和西班牙。其中,试验组治疗方案为:每周一次注射efsitora+赖脯胰岛素(速效胰岛素,通常在餐前使用,有效时间约2~5h),对照组治疗方案为:每日一次甘精胰岛素(赛诺菲)+赖脯胰岛素。
试验的主要终点是,26周时efsitora降低A1C的效果不亚于甘精胰岛素。
结果显示,26周时,efsitora降低了1.07%的A1C(7.12%),甘精胰岛素同样降低了1.07%的A1C(7.11%),试验达到主要终点。
安全性方面,以目前长效胰岛素最普遍也是最难解决的低血糖事件(血糖 <54 mg/dL)发生率来讲,efsitora vs 德谷胰岛素 (0.58 vs 0.45),efsitora vs 甘精胰岛素 (6.6 vs 5.9),均略高于对照组,但差距并不大。
根据礼来官方披露信息,efsitora整个注册性QWINT研究共纳入了五项试验,在今年的欧洲糖尿病研究学会(EASD)年会上(预计9/10月举行)将公布另外三项QWINT-1、QWINT-3和QWINT-5的主要结果和QWINT-2的更多详细结果。其中预估将包括针对T1DM患者数据。
目前来看,efsitora的数据可圈可点,那其是否会是全球第一个上市的周制剂胰岛素?
03 诺和诺德领先
深耕胰岛素领域多年的诺和诺德在胰岛素周制剂上又一次领先。
美国东部时间2024年5月24日,FDA召开内分泌学和代谢药物咨询委员会,会议的主要议题是:讨论诺和诺德提交的NNC0148-0287注射液(insulin icodec,周制剂胰岛素)的BLA(761326)申请的安全性和有效性。
根据诺和诺德官网信息,icodec 的注册性ONWARDS 研究共由6项研究组成。其中,ONWARDS 1~5仅纳入了T2DM患者,ONWARDS 6仅纳入T1DM患者。
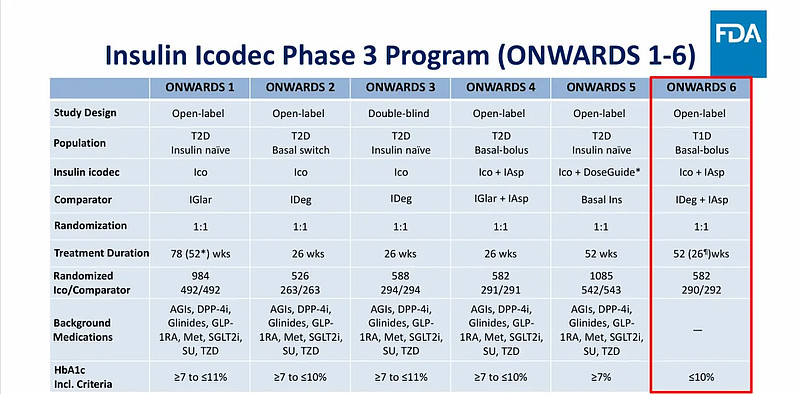
图片来源:FDA官网
此次FDA会议主要围绕ONWARDS 6 研究展开。资料显示,ONWARDS 6共纳入582名T1D患者,试验组患者治疗方案为:每周一次icodec +门冬胰岛素(速效胰岛素,用于餐后血糖控制),对照组患者治疗方案为:每日一次德谷胰岛素+门冬胰岛素。
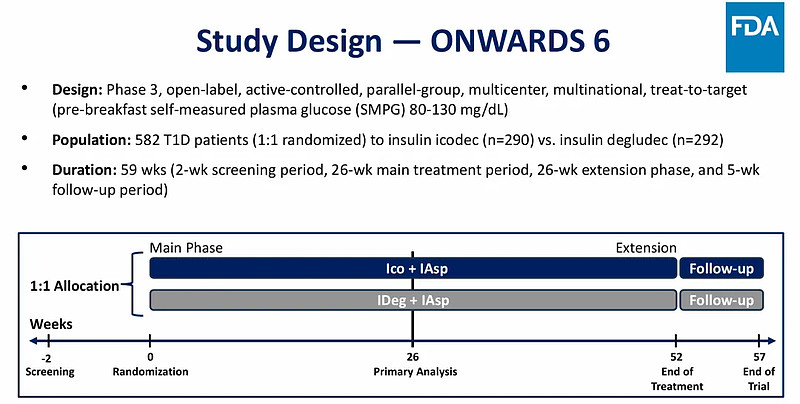
图片来源:FDA官网
对于试验结果的有效性,FDA认为26周时icodec组的整体疗效的确与德谷胰岛素组相当,但52周时的结果显示德谷胰岛素组更胜一筹。但无疑的是icodec组在26周、52周时均显著降低了AIC。

图片来源:FDA官网
目前,FDA对于ONWARDS 6 的质疑主要集中在安全性方面。FDA简报文件中指出,在ONWARDS 6 研究中,与德谷胰岛素组相比,icodec 组的2/3级低血糖事件发作率显著更高。
事实上,低血糖事件是外源性胰岛素使用中最大的限制因素,这不只局限于ONWARDS 6研究。
Marc-Andre Cornier博士(Medical University of South Carolina大学医学教授)曾在国外媒体VERY WELL的采访中提到:“在使用胰岛素的过程中,注射过量胰岛素的情况并不罕见。周制剂胰岛素的潜在缺点在于短期内更难进行调整,因为这种制剂在体内作用时间很长。如果要使用周制剂胰岛素,建议提供连续血糖监测。”
在此次FDA会议上,诺和诺德也提出了相应措施,即在icodec的标签中标识低血糖风险,并要求医院/医师将其仅应用于使用连续血糖监测设备/血糖变异性低的那一部分患者。
从多方面信息来看,诺和诺德的这款周制剂胰岛素被FDA批准上市的希望还是很大的,但是否能一下子覆盖到T1DM和T2DM所有患者还有待考量。
目前,诺和诺德的这款周制剂胰岛素已通过CHMP(欧洲药品管理局人用药品委员会)的首肯,被其推荐上市用于T2DM患者的血糖控制(基于ONWARDS 3研究,这项研究仅纳入T2DM患者 )。
在2024年3月21日发布的公告中,诺和诺德表示预计这款产品将在大约两个月内获得欧盟委员会的最终上市授权。

图片来源:诺和诺德官网
小结
对于广大的慢性病患者人群而言,用药需求已经由“有药可用”上升到“需要更长效,更有效的药”。周制剂胰岛素需要解决的问题还有不少,但是若能成顺利上市,必然是降糖领域的又一里程碑。
参考资料:
1.Lilly Releases Promising Clinical 3 Trial Results for Once-Weekly Insulin (verywellhealth.com)
2.各公司官网
3.FDA官网
4.其他公开资料
封面图来源:pixabay
