

2024年5月21日,中国国家药品监督管理局(NMPA)官网公示,礼来穆峰达®(替尔泊肽注射液)获批上市,适用于在饮食控制和运动基础上,接受二甲双胍和/或磺脲类药物治疗血糖仍控制不佳的成人2型糖尿病(以下简称:T2DM)患者。(见图1)
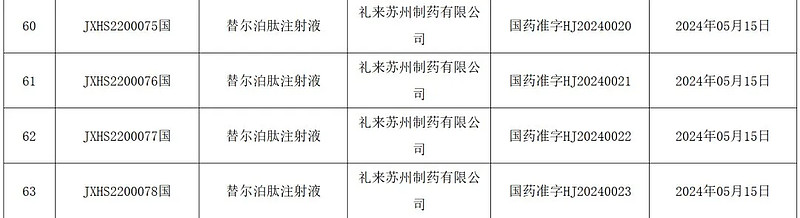
图1:替尔泊肽注射液获批上市(图片来源:NMPA官网)
01 替尔泊肽获批历程
2022年5月,替尔泊肽获美国食品和药物管理局(FDA)批准用于改善成人2型糖尿病患者的血糖控制(在饮食控制和运动基础上),成为全球首款GLP-1/GIP双靶点受体激动剂。
2022年9月,礼来在中国递交替尔泊肽用于治疗成人2型糖尿病患者血糖控制注册申请。
2023年11月,FDA批准替尔泊肽用于改善肥胖或至少有一种合并症的超重成人的长期体重管理(在低热量饮食和增加体力活动基础上)。
截止日前,替尔泊肽已在欧盟、日本等多个国家获批上市,治疗2型糖尿病。
02 替尔泊肽的临床数据
替尔泊肽能够选择性结合并激活GIP(葡萄糖依赖性促胰岛素多肽)受体和GLP-1受体两种天然肠促胰素受体,降低T2DM患者的空腹和餐后血糖水平。替尔泊肽注射液目前有4种规格:2.5 mg:0.5ml,5 mg:0.5ml,7.5 mg:0.5ml,10 mg:0.5ml。
此次替尔泊肽在华获批,主要基于其在T2DM患者中开展的全球关键III期注册试验SURPASS 1-5,以及以中国患者为主的亚太地区关键III期注册试验SURPASS-AP-Combo。
SURPASS系列研究主要评估了替尔泊肽作为单药治疗和联合T2DM具有代表性的各类降糖药物治疗的有效性与安全性。研究中的活性对照药物包括注射司美格鲁肽 1 mg、甘精胰岛素与德谷胰岛素。(见图2)
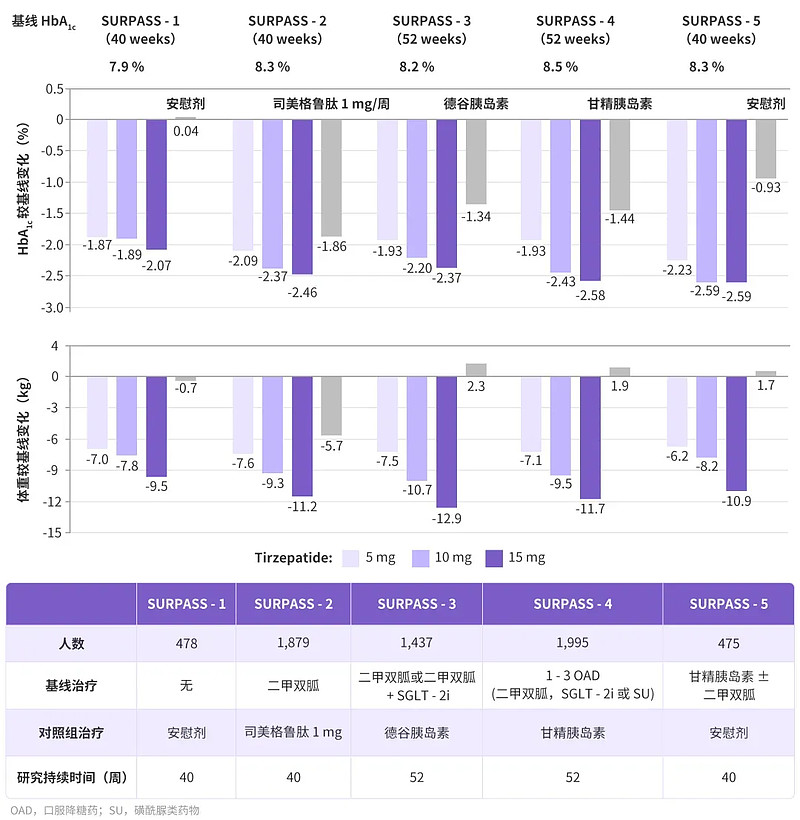
图2:SURPASS 1~5 研究数据结果(图片来源:丁香园)
结果表明,对于处于不同糖尿病病程(平均病程5至13年)的T2DM受试者,替尔泊肽各剂量组均可显著降低糖化血红蛋白,且降糖幅度领先所有对照组。
其中,在最为人熟知的与司美格鲁肽头对头SURPASS-2研究中,替尔泊肽各剂量组HbA1c与体重降幅均优于对照组。(见图3)
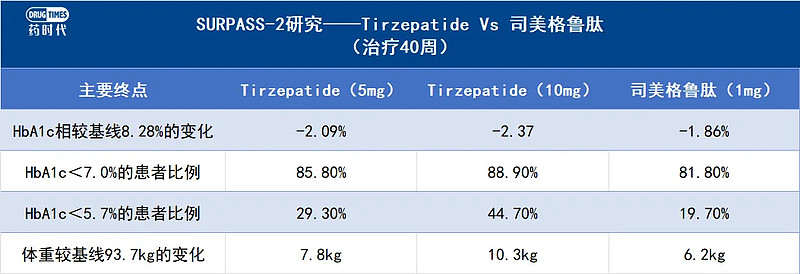
图3:SURPASS-2研究治疗40周后,替尔泊肽5mg,10mg与司美格鲁肽1mg的终点结果对比
值得注意的是,在2023年的美国糖尿病学会(ADA)年会上,研究者重新把替尔泊肽SURPASS 1-5系列研究数据拿出来,验证T2DM患者早期体重减轻的程度对后期体重与血糖的影响。
结果显示,早期做到体重减轻大于等于5%的糖尿病患者,在大约10个月后,相比其他患者的糖化血红蛋白(HbA1c)和体重下降幅度更大,而且实现体重血糖“双重下降”效果的人数更多。也就是说,替尔泊肽具有实现血糖、体重“双达标”的能力。(见图4)
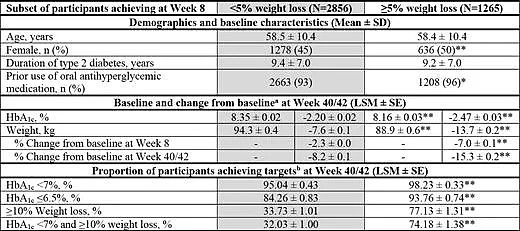
图4:SURPASS 1-5系列研究中,比较替尔泊肽早期体重减轻的程度对后期体重与血糖的影响
至于SURPASS-AP-Combo研究,是一项以中国成人T2DM患者为主,旨在评估二线使用替尔泊肽降糖效果的临床研究,受试者均为接受二甲双胍治疗(联合或不联合磺脲类药物)后血糖控制不佳的T2DM患者。
该试验共纳入917例患者(其中763例为中国患者,占比83.4%),4等分进入3个试验组和1个对照组,试验组为5、10、15mg的替尔泊肽,对照组为甘精胰岛素。
结果表明,在治疗40周时,替尔泊肽各剂量组自基线HbA1c的降幅均优于对照组。其中5mg、10mg治疗组受试者第40周时HbA1c较基线的平均降幅为2.24%、2.44%,甘精胰岛素组HbA1c平均降幅为0.95%。
此外,体重自基线的平均变化是关键次要终点之一,替尔泊肽5mg、10mg受试者体重平均降低5.0 kg、7.0kg,甘精胰岛素组体重平均增加1.5kg。
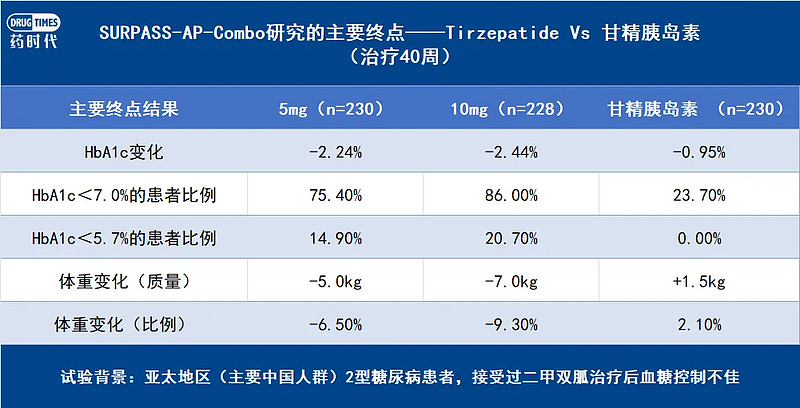
图5:SURPASS-AP-Combo治疗40周后,替尔泊肽与甘精胰岛素的主要结果对比
与司美格鲁肽的亚太地区III期试验SUSTAIN China(受试者有70%来自中国)做个非头对头对比。替尔泊肽10mg剂量组在HbA1c与体重的降幅均优于司美格鲁肽各剂量组。(见图6)
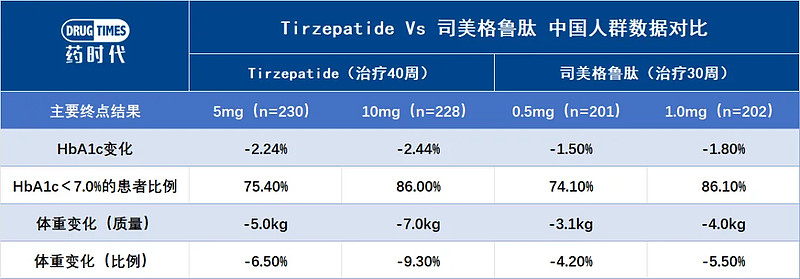
图6:SUSTAIN China治疗30周与SURPASS-AP-Combo治疗40周后,替尔泊肽与司美格鲁肽的主要结果对比
目前,我国现接受治疗的T2DM患者中,达到指南推荐目标值(HbA1c≤7%)的不到半数。此次替尔泊肽获批,是否对面前GLP-1研发格局带来影响?因为其实现了比指南建议更高标准的综合达标,即:HbA1c≤6.5%、体重下降≥10%、无有临床意义低血糖且无严重低血糖事件。
03 关于替尔泊肽,你可能还想知道
除了本次批准的降糖适应症外,替尔泊肽还相继布局了减重、MASH(代谢相关脂肪性肝病)、心血管疾病、慢性肾病、睡眠呼吸暂停综合征等诸多适应症。
其中,礼来于2023年8月向NMPA递交了替尔泊肽用于长期体重管理适应症的上市申请。注册申请基于26项替尔泊肽临床研究结果,其中包括在中国肥胖或超重成人中开展的III期注册临床试验SURMOUNT-CN。
SURMOUNT-CN研究表明,第52周时 替尔泊肽10mg、15mg剂量组平均体重自基线分别降低14.4%、19.9%,均优效于安慰剂组(降低2.4%),且总体安全性与先前试验报道相似。
目前,虽然替尔泊肽已在国内申报减重适应症,但考虑到医保等影响因素,国内对GLP-1用于减重适应症的审批较为严谨,想要短期内拓展适应症,并不现实。
据不完全统计,目前在我国上市GLP-1类药物中,只有华东医药的利拉鲁肽与仁会生物的贝那鲁肽获批减重适应症。
不过,随着玛仕度肽、司美格鲁肽及其生物类似药等GLP-1类药品纷纷递交了针对减重适应症的上市申请,NMPA针对GLP-1在减重适应症的态度或将放缓,期待未来GLP-1类药物可更进一步,惠及广大患者,药时代将持续关注。
封面图来源:pixabay
