

正文共2098字 共2图
预计阅读时间:8分钟
如果FDA将MRD(微小病灶检测)正式作为MM(多发性骨髓癌)药物加速批准的依据,会给整个领域带来什么影响?
“一旦FDA关于MRD可用于加速批准的指导原则公布,它将会改变临床前建模、临床开发及早期临床试验的激励结构,因此FDA必须保持警惕。”美国国家癌症研究所高级临床医师Madan博士如是说。
01 全票通过
“这是多发性骨髓癌领域的历史性胜利!”ODAC(肿瘤药物咨询委员会)会议结束后,Carl Ola Landgren教授在LinkedIn上分享道。
2024年4月12日举行的ODAC会议以12:0的结果,赞成将MRD作为MM(多发性骨髓癌)加速批准的替代终点。
MM是一种恶性浆细胞疾病,属于发病率较高的血液瘤,好发于40岁以上成年人,一般情况下男性发病率高于女性。随着人口老龄化加剧和诊断技术的进步,MM发病率逐年攀升。
MM在临床上具有隐匿性,很多处于疾病早期的MM患者并不会表现出明显症状。且由于患者的临床症状表现复杂,多数患者易被误诊、漏诊。
目前国内外均已经获批多款MM治疗药物,比如一直处于“风口浪尖”的CAR-T疗法,以达雷妥尤单抗(强生)和艾沙妥昔单抗(赛诺菲)为代表的CD38单抗,以及来那度胺、沙利度胺、硼替佐米等。
一众MNC中,强生对MM领域可谓是相当青睐。除了有硼替佐米、达雷妥尤单抗(年销售额近百亿美元)两个大单品,还有众多在研管线。其中涉及到的靶点包括BCMA、GCPR5等,管线中还有一些双抗+CAR-T及双抗+双抗的组合产品。从强生的MM领域布局来看,似有覆盖大部分MM领域临床需求的能力和雄心。
众多MM治疗药物的上市缓解了急迫的临床需求。但是,MM仍然是一种无法治愈的疾病。很多患者在接受一次治疗后,还会面临很高的疾病复发率,而患者能用的后线药物是有限。ODAC会议上,有专家提到MM的死亡率并不低,5年生存率为59.8%,临床上对MM药物的需求一直存在。
目前,MM新药获批上市主要走常规批准流程(regular approval)和加速批准流程(accelerate approval)。常规情况下,OS(总生存期)是肿瘤药物获批上市的金标准,但目前MM药物可依据PFS(无进展生存期)获批上市。
在有足够优异的临床表现的情况下,一些MM领域新疗法的加速批准上市也可接受ORR等作为替代终点,但最终获批仍需OS、PFS等硬终点数据/确证性研究数据的支持。
重点在于,获得OS,PFS数据以明确疗效的过程的时长太久,一般需要7、8年或者更久。另外,Landgren教授指出,ORR也并不是一个完美的终点,因为ORR只是一个短期疗效指标。
因此,MM领域急需一个可靠的早期终点。
MRD(Minimum Residual Disease),中文为最小残留病或微小残留病,是指在治疗后患者体内仍存在但常规检测方法无法检出的极少量恶性细胞。目前,MRD是一些常见血液瘤(MM,白血病,淋巴瘤等)的临床常用检测手段。
2009年,当时在美国国家癌症研究所(NCI)工作的Landgren教授等人发起了一项涉及FDA和国家心肺血液研究所(NHLBI)的跨机构倡议,涉及MRD在MM领域的应用。这也是本次ODAC会议所涉及内容的源起之处。
图片来源:FDA官网
02 两项荟萃分析研究
本次ODAC会议由FDA、Miami大学Sylvester癌症中心、骨髓瘤MRD终点批准国际独立小组三方共同支持下进行,主要是对两项独立的荟萃分析EVIDENCE和I2TEAMM研究的结果进行分享和讨论。
接下来笔者将对两项荟萃分析结果进行简单介绍:
· EVIDENCE
EVIDENCE由Miami大学Sylvester癌症中心发起,根据Landgren教授提供的信息,此项研究于2009年开启,距今历时15年。整个研究最终纳入了16项临床试验数据,MRD检测的灵敏度水平至少为10-5,试验的主要入组人群为NDMM(新诊断的多发性骨髓瘤)患者。
研究结果显示,无论是从患者个体水平还是试验水平对数据进行分析的结果都显示RMD与PFS及OS有良好的相关性(数据见下图),这意味着MRD可以合理预测MM的长期预后和临床获益,可用于MM加速批准的早期临床终点。
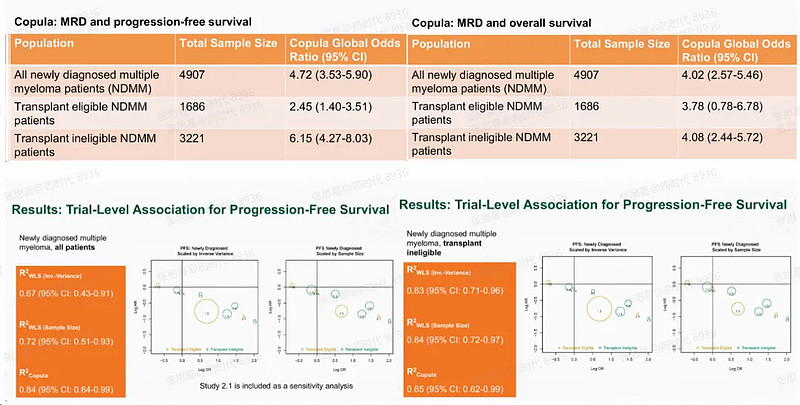
图片来源:FDA官网
· I2TEAMM
I2TEAMM研究由骨髓瘤MRD终点批准国际独立小组发起,研究共纳入20个随机化对照III期试验,试验地点几乎覆盖全球。
研究主要证明了以下几点:
1.MRD与PFS、OS有良好的相关性。
2.MRD能合理预测MM的长期预后和临床获益。
3.不同的MRD检测技术所得结果间无明显差异。
4.MRD检测的灵敏度越高,对临床获益的预测更有益。
5.MRD在不同类型的MM(即无论是否为新发MM,无论MM是否可移植)中都表现出了与PFS的良好相关性。
6.MRD在所有治疗方式(包括CAR-T及TCE)中都表现出与PFS的良好相关性
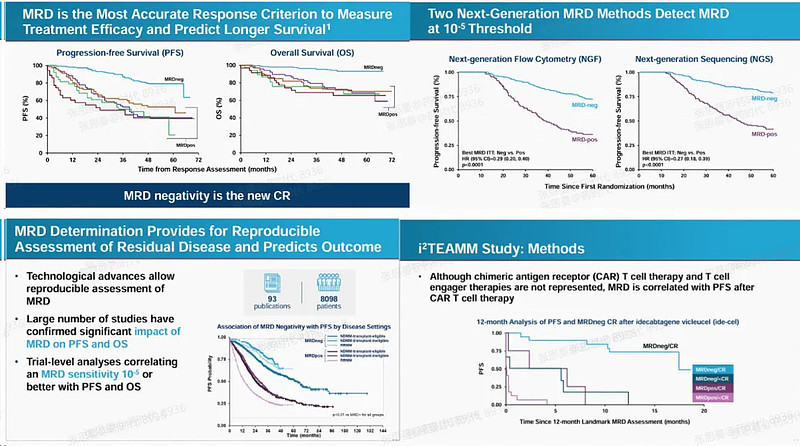
图片来源:FDA官网
此外,研究结果还表明9个月及12个月时MRD与PFS相关性均良好。
03 小结
会议刚开始时就指出,此次会议将围绕三个重点话题展开:(1)现有数据是否足够充分去支持MRD作为MM加速批准终点使用;(2)现有数据是否支持MRD作为不同类型MM临床试验的终点;(3)MRD评估时间点的可接受性,包括:9个月、12个月等。

图片来源:FDA官网
两项荟萃分析研究所证明的内容基本可以很好回答上述三个问题。综合考虑,FDA最终大概率会作出与此次ODAC会议投票结果一致的决定。
在会议最后,FDA对两项荟萃分析研究的结果表示初步认可,但也提出两项研究目前还存在一些局限性,比如所纳入的试验的差异性、MRD检测技术的差异性等。
此外,FDA基于两项研究作了进一步的数据分析,结果显示:从个体水平来看,MRD与PFS、OS相关性良好,与两项试验所展示结果一致;但由于对部分数据的处理方式不同,导致从试验水平来看,MRD与PFS在大多疾病亚组中显示出弱/中等的相关性,且与OS的相关性为弱/中等。
整体考虑后,FDA初步认为MRD可以作为支持加速批准的终点,但能否支持常规批准还有待考量。
参考资料
1.FDA官网
2.FDA 的 ODAC 以 12 票对 0 票认为 MRD 是骨髓瘤试验的可行终点 (targetedonc.com)
3.其他公开资料
封面图来源:pixabay
