

01 第二天:裁员
CAR-T研发药企们已经经过了惊魂一昼夜,但真正的危机才刚刚开始。
据多家媒体消息,吉利德旗下药企Kite Pharma,也就是持有Yescarta和Tecartus两款重磅疗法的龙头CAR-T药企,其执行副总裁Cindy Perettie昨日在员工信中披露了一项“更新的业务战略”,旨在更好地协调部门的战略重点。
吉利德发言人确认,Kite将裁员7%,以Kite目前大约有4000名员工为计,本次裁员将波及300人左右。另外Kite将新建90个工作岗位,所以净裁员在5%上下。
Kite在一份声明中表示:“虽然我们的业务表现良好,我们正在为有资格接受CAR - T治疗的患者带来有意义的影响,我们相信,我们的疗法仍有很大的机会继续被采用。”“因此,我们正在采取措施进一步调整我们的业务,以适应未来的增长,包括精简组织的某些领域,以更好地优化运营效率。”
吉利德(Kite)打响了CAR-T裁员的第一枪,而这一切仅发生在FDA宣布将对所有BCMA或CD19 CAR-T(所有已上市CAR-T均为此二靶点)进行审查的第二天。‘
02 FDA的“异动”
2023年11月28日,美国FDA宣布收到了接受BCMA或cd19导向的自体CAR T细胞免疫疗法治疗的患者发生T细胞恶性肿瘤(包括嵌合抗原受体CAR阳性淋巴瘤)的报告。

图片来源:FDA官网
根据FDA新闻稿中的表述,“FDA已经确定,T细胞恶性肿瘤风险适用于所有目前批准的BCMA和CD-19导向的转基因自体CAR - T细胞免疫疗法。T细胞恶性肿瘤已经发生在采用此类疗法的患者中。尽管这些产品的患者总体获益仍然超过其潜在风险,但FDA正在调查已确定的T细胞恶性肿瘤的严重后果风险,包括住院和死亡事件,并正在评估监管行动的必要性。”

目前由Peter Marks(FDA CBER主任)领导FDA的生物制剂部门探索CAR-T细胞疗法治疗继发性癌症的风险。图片来源:(Greg Nash/AFP/Getty Images)
这意味着一旦CAR-T疗法会引起T细胞肿瘤的情况坐实,所有已上市CAR-T都会被标注一类警告,在临床上肯定是需要重新评估患者获益与风险问题的。
不过最耐人寻味的莫过于那句“正在评估监管活动的必要性”,是怎样的监管活动?会有CAR-T疗法面临撤市风险?还是说要重新调整适用人群,让本就是后线治疗方案的CAR-T疗法的“优先度”进一步降低?
各家药企纷纷表态,目前没有证据证明发生T细胞瘤与CAR-T疗法直接相关。也有许多临床医生对FDA的态度表示不解:不管怎么说,就现阶段的实践情况来看,CAR-T的患者获益还是要大于风险的。
03 CAR-T的喜忧参半之年
尽管11月28日FDA才发出公告,但恐怕风声早已在CAR-T业界中流传,近期的消息喜忧参半,某种程度上印证了CAR-T疗法仍然存在诸多不确定性。
最近的一次是2023年12月16日,BMS的BCMA CAR-T Abecma就已遭遇意外:BMS希望将Abecma的适应症标签扩大至复发性或难治性多发性骨髓瘤的三线治疗,但FDA突然决定延缓原定于2023年12月16日的PDUFA日期,转而召开专家咨询委员会,审查与Abecma总生存期(OS)次要终点相关的数据。
此前的临时变卦似乎已经说明FDA有加强CAR-T疗法审查的欲望,但没想到竟会是如此剧变。
Abecma由BMS与2seventy bio联合开发,后者拆分自明星biotech 蓝鸟生物,但在今年2seventy bio也陷入了一系列风波之中。
2023年6月,其在研CD33 CAR-T疗法SC-DARIC33在1期临床试验中,一名急性髓性白血病(AML)儿童患者在剂量爬升后死亡,试验主动暂停。8月,FDA确认试验正式搁置,目前仍处于调查阶段,距离试验恢复依旧遥遥无期。
到了公布2023年3季度报时,2seventy终于表示自己撑不住了,宣布裁员40%以维持现金流至2026年。
在众多CAR-T疗法的开发过程中,患者死亡的情况不是第一次发生。JUNO、Kite、bluebird等CAR-T先驱都在产品开发过程中遭遇了患者死亡,也都被FDA叫停了临床试验。但毕竟CAR-T治疗的成本高周期长,普遍为极后线甚至是末线疗法,所以采用CAR-T疗法的普遍系危重病人,这类患者本身就极易突发意外,患者死亡实际上说明不了太多问题。
04 问题出在载“CAR”的car身上?
实际上也可以反过来说:由于患者病情危重复杂,也确实可能会发生一些超出意料的病情进展。
在FDA发布公告后,传奇生物也紧跟着发布了声明。声明指出,“即使没有CAR-T治疗,多发性骨髓瘤患者也可能发生T细胞恶性肿瘤。综合多个数据,2018年至2022年的患者发病率为0~554/10万。此外,其他骨髓瘤相关治疗方案,如烷化剂、免疫调节药物和自体干细胞移植等均与继发性癌症风险增加相关。”
知名医药媒体Fierce Pharma检索了FDA数据库,目前已上市的六款CAR-T产品总共报告了12例T细胞瘤不良事件,考虑到全球已有上万名患者接受过CAR-T治疗,这个发生率和传奇生物的表态基本一致,确实说明不了问题。
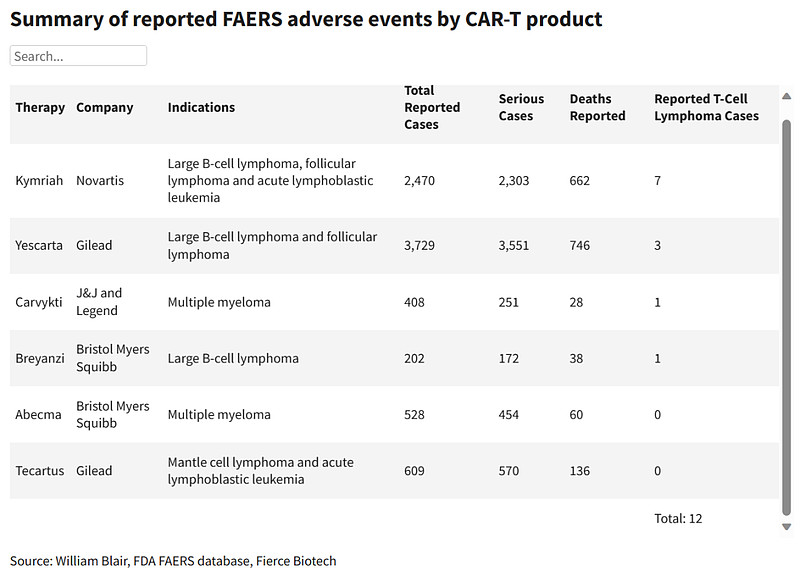
图片来源:Fierce Pharma
也就是说,FDA必须拿出令人信服且实锤的具体证据,才能把CAR-T疗法和恶性T细胞瘤联系起来。
FDA 指出,CAR-T技术所使用的慢病毒载体理论上可能会增加继发性癌症的风险。实际上也不只是CAR-T,所有采用慢病毒载体作为“运输工具”的基因编辑疗法都有潜在致癌风险。
这里需要替FDA解释一下。
CAR-T技术里,最重要的就是那个“CAR”。CAR基因可以赋予T细胞对肿瘤细胞的特异性识别和杀伤能力,但CAR基因需要一个载体才能融入到T细胞的基因组之中,经过了基因编辑的慢病毒载体在其中发挥着作用,可以将CAR基因传递到T细胞内部。
但就像是士兵一直需要弹药供给,为了能够维持T细胞对肿瘤的杀伤能力,CAR基因不仅需要被传递到T细胞中,还必须能够在患者的T细胞内持续表达,以确保CAR-T细胞的长期抗肿瘤活性。而慢病毒载体通过将自身基因的与T细胞的基因组整合,就可以随细胞分裂而持续存在,这些慢病毒载体继续在患者体内工作,确保CAR基因能够在T细胞内持续存在并表达。
问题在这里就出现了:虽然说绝大多数情况下慢病毒载体的基因表达都是有益且必要的,但实际上我们并不能精确的控制慢病毒载体基因在T细胞基因中的表达位置,在极其少数的情况下,慢病毒载体的基因插入位点会在与癌症相关的位点附近,此时就有致癌风险了。
以上均为理论可能性,没有真实世界例证。所以还是要等FDA把具体案例掏出来,和已上市CAR-T药企掰扯掰扯。
05 地球同时陷入黑夜
无论如何,短期内CAR-T相关产业的投资、研发,CAR-T在临床上的应用考量会发生波动已是板上钉钉之事,或许也正是因为短期内必然的波动,比如说销售额下降,Kite所以会选择裁员。
如果将眼光放长远,我们假定FDA的观点为真,且有必要就CAR-T的致癌风险采取监管行动,那么“抗癌疗法具有明确的致癌风险”就会像三体人派出的智子一样牢牢锁死CAR-T在诊疗方案中的地位。
如果我们依然将CAR-T定为末线治疗、最后手段,那么即便是有一定的患T细胞瘤的风险,大概率也是可以容忍的。但如果各类CAR-T产品想要提线,比如说像Abecma这样想要提到三线治疗方案,那么就必须严肃衡量潜在致癌风险。
自2017年两款CAR-T产品获批以来,全球CAR-T疗法市场迅速扩张。据Frost&Sullivan预测,按销售价值计,全球CAR-T市场规模已从2017年的0.1亿美元增至2020年的11亿美元,预计全球CAR-T细胞疗法市场销售价值达2030年的218亿美元,2021-2030年的年复合增长率为34.8%。据医药魔方数据统计,2012年至2023年1月,CAR-T相关交易累计173起,累计首付款19.2亿美元,累计总交易金额300.7亿美元。
而中国药企是CAR-T疗法当之无愧的重要研发核心,根据智慧芽数据库统计,目前在ClinicalTrials上共有969项CAR-T临床试验登记,其中中国地区占548项,美国占268项,数值差距惊人。目前国内已有 4 款 CAR-T 疗法获批上市,CAR-T BD交易也异常活跃,且绝大多数在研CAR-T产品归属于BCMA或CD19两大靶点。

尽管科济药业没有已上市CAR-T产品,但作为中国CAR-T领军企业,已在今日就相关事件发布声明
但由于CAR-T疗法客观存在的成本与经济效益问题,美国才是CAR-T疗法的主要消费市场,出海是国产CAR-T的必然。FDA在CAR-T领域的一举一动,都会让地球另一端的中国CAR-T研发药企们抖三抖。
如果FDA最终选择对BCMA或CD19 CAR-T执行“监管行动”,那太平洋彼岸的“大地震”,将会在不久后于此岸引发海啸。
参考资料
2seventy bio Announces Strategic Restructuring to Prioritize Growth of Abecma, Streamline Pipeline Advancement and Preserve Financial Runway | 2seventy bio
Bristol Myers Squibb - Bristol Myers Squibb and 2seventy bio Provide Update on U.S. FDA Review of sBLA for Abecma (idecabtagene vicleucel) in Earlier Lines of Therapy for Triple-Class Exposed Relapsed or Refractory Multiple Myeloma
Benefits Outweigh Risks as FDA Inspects CAR-T Cell Therapy-Related Cancer (curetoday.com)
FDA Investigating Serious Risk of T-cell Malignancy Following BCMA-Directed or CD19-Directed Autologous Chimeric Antigen Receptor (CAR) T cell Immunotherapies | FDA
FDA probes CAR-T therapies' 'serious risk' of secondary cancer (fiercepharma.com)
其他互联网公开资料
封面图来源:Pixabay-Rollstein
