

北京时间2023年08月01日,GSK宣布FDA批准了Dostarlimab联合卡铂和紫杉醇后, Dostarlimab可作为单药物继续治疗患有错配修复缺陷(dMMR)或微卫星不稳定性高(MSI-H)的原发性晚期和复发性子宫内膜癌的成年患者。

子宫癌是全球第二常见的妇科恶性肿瘤,在发达国家发病率很高。其中,子宫内膜癌占子宫癌病例的90%以上。对于晚期子宫内膜癌,通常卡铂和紫杉醇或多柔比星和顺铂化疗被认为是标准治疗过程,但部分患者的肿瘤在化疗过程中可能会出现耐药性。
此次的主角Dostarlimab,此前已被FDA批准可作为单药用于治疗接受含铂化疗后疾病出现复发且携带错配修复缺陷(dMMR)DNA修复异常的复发或晚期子宫内膜癌患者。Dostarlimab是一款人源化抗PD-1的单克隆抗体,通过与PD-1受体结合阻断其与配体PD-L1和PD-L2的相互作用。这一阻断作用可促进免疫系统消灭癌细胞。
这是FDA批准的第一个可用于一线治疗子宫内膜癌与化疗联合的免疫疗法。这对于该类肿瘤患者来说,可能是一个不错的新选择。
此次获批基于一项名为RUBY(NCT03981796)的3期临床试验,该研究共纳入494名原发性晚期或复发性III/IV期子宫内膜癌患者,其中有118个受试者为高dMMR/MSI人群。将全部受试者按照1:1的比例分为Dostarlimab组(n=245)和安慰剂组(n=249),两组均附加卡铂和紫杉醇,每3周一次(6个周期)。之后,每6周接受一次dostarlimab或安慰剂。
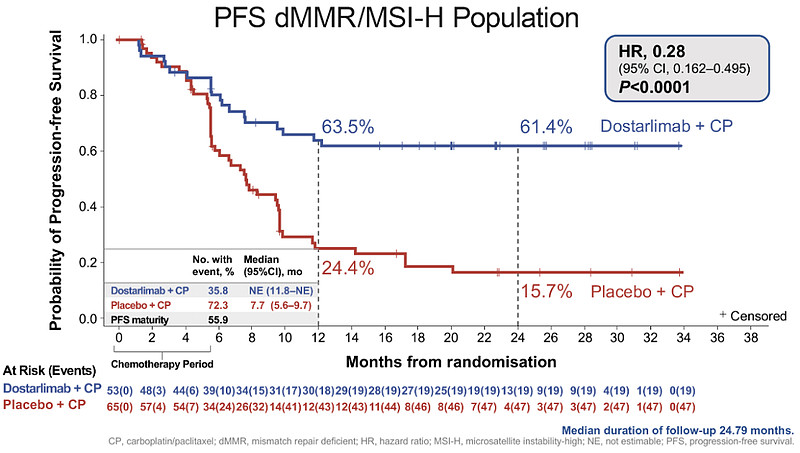
结果显示,在高的dMMR/MSI用药组中,24个月的无进展生存率为61.4%,而安慰剂组为15.7%,存在显著性差异。而在总体患者人群中,Dostarlimab组24个月的无进展生存率为36.1%,安慰剂组为18.1%。dostarlimab组的总生存率为71.3%,安慰剂组为56.0%。
在安全性方面,两组常见的不良事件是恶心、脱发和疲劳等。Dostarlimab组的严重不良事件发生率大于等于20%,主要症状为皮疹、腹泻、甲状腺功能减退和高血压。总体与各药物已知安全性一致。
另外,默沙东也宣布了一项关于帕博利珠单抗联合化疗治疗子宫内膜癌的研究结果,与单纯化疗相比,帕博利珠单抗联合化疗将将dMMR患者的疾病进展或死亡风险显著降低了70%,但目前来看GSK暂居领先地位。
总之,该疗法大大提升了患者的生存时长,未来可能会成为治疗该类型子宫内膜癌的首选方案。
参考文献:
1. GSK官网
2. 默沙东官网
3. Faizan U, Muppidi V. Uterine Cancer. [Updated 2022 Sep 5]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan-. Available at: 网页链接
4. Braun MM, et al. Am Fam Physician. 2016;93(6):468-474.
5. International Research on Cancer. Global Cancer Observatory. Cancer Tomorrow. 网页链接 Accessed 13 July 2022.
6. Kantar Health, Cust Study (2018).
7. Laken H, Kehry M, Mcneeley P, et al. Identification and characterization of TSR-042, a novel anti-human PD-1 therapeutic antibody. European Journal of Cancer. 2016;69,S102.
封面图来源:123rf
