

2023年8月1日(北京时间),复旦大学基础医学院王明伟团队携手中国科学院上海药物研究所杨德华团队在Cell Discovery在线发表了题为“Structural insights into ligand recognition and subtype selectivity of the human melanocortin-3 and melanocortin-5 receptors”的研究论文。该论文首次报道了人源黑素皮质素受体3(Melanocortin-3 receptor, MC3R)结合内源性选择性配体γ-黑色素细胞刺激素(γ-Melanocyte-stimulating hormone, γ-MSH)以及人源黑素皮质素受体5(MC5R)分别结合内源性非选择性配体α-MSH和合成多肽配体PG-901与下游Gs蛋白复合物的冷冻电镜结构,结合大量功能实验数据,不仅系统阐明了内源性配体亚型选择性的结构基础,而且揭示了PG-901激动MC5R但拮抗MC3R的分子机制。

黑素皮质素系统是神经–免疫–内分泌轴的重要组成部分,由五种黑素皮质素受体(MC1R-MC5R)、四种黑素皮质素(α-MSH、β-MSH、γ-MSH和ACTH)和两种内源性拮抗剂(Agouti和Agouti-related peptide, AgRP)组成1。五种受体通过与内源性配体结合参与多种生理调控,如MC1R与皮肤色素沉着和免疫反应密切相关;MC2R参与肾上腺皮质激素的生成;MC3R和MC4R是神经系统控制食欲、能量代谢及性功能的关键组成部分,而MC5R与外分泌腺功能高度相关2-5。
目前已有多种靶向MCRs的内源性多肽配体类似物用于治疗肥胖症、关节炎、皮肤病和性欲减退等6, 7,如α-MSH类似物布美诺肽(Bremelanotide)和赛美拉肽(Setmelanotide)分别于2019年和2020年获批上市用于治疗绝经前女性性欲减退症和因黑素皮质素原和瘦素受体等基因缺陷导致的肥胖症。然而,由于这五种受体的序列高度保守,使得相关药物的亚型选择性较差,存在皮肤色素沉积、心动过速和血压升高等副作用,限制了临床应用。不久前,王明伟/杨德华团队、中国科学院上海药物研究所徐华强团队和浙江大学医学院张岩团队紧密合作,先后获得了MC1R8、MC2R9和MC4R10的三维结构。在此基础上进一步解析MC3R和MC5R的精细结构将深化人们对这个受体家族的认识。
为此,王明伟/杨德华研究团队经过多轮载体筛选和应用NanoBiT系连技术11获得了颗粒均一且性状稳定的MC3R和MC5R蛋白复合物,应用冷冻电镜技术成功解析了分辨率分别为2.86 Å、2.73 Å和2.59 Å的γ-MSH–MC3R–Gs、α-MSH–MC5R–Gs和PG-901–MC5R–Gs三个复合物的立体结构(图1)。
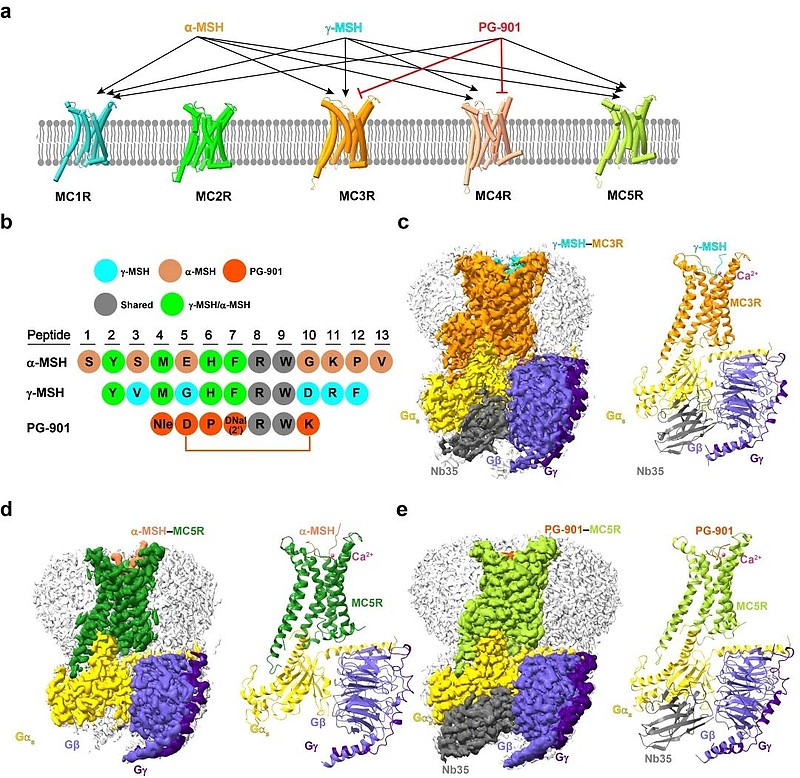
图1. γ-MSH–MC3R–Gs、α-MSH–MC5R–Gs和PG-901–MC5R–Gs复合物的冷冻电镜结构。a-b, γ-MSH、α-MSH和PG-901与黑素皮质素受体的作用示意图 (a) 及其氨基酸序列比对 (b);c-e, γ-MSH–MC3R–Gs (c)、α-MSH–MC5R–Gs (d) 和PG-901–MC5R–Gs (e) 的复合物结构。
研究表明,γ-MSH、α-MSH和PG-901均呈“U”形插入受体的正构口袋,其中黑素皮质素高度保守的HFRW基序深入受体跨膜域(Transmembrane domain, TMD),与受体形成了广泛的相互作用。内源性选择性激动剂γ-MSH对MC3R具有最高的激动活性。综合序列比对、结构叠合对比及功能实验结果,研究人员发现γ-MSH的羧基末端和MC3R的异亮氨酸I2656.58(遵循Ballesteros–Weinstein编号规则12)可能是决定γ-MSH亚型选择性的关键因素(图2)。PG-901是MC5R的高活性完全激动剂,却是MC3R的拮抗剂。结构和功能分析显示,3.36(MC5R中为V1263.36,MC3R中为L1283.36)是PG-901激动MC5R和拮抗MC3R的关键位点。此外,研究人员还发现了不同二价金属离子对黑素皮质素受体的cAMP信号通路迥异的调控作用。

图2. γ-MSH选择性识别MC3R的分子机制。a, γ-MSH与MC3R相互作用的示意图;b-d, γ-MSH的氨基末端 (b)、HFRW基序 (c) 和羧基末端 (d) 与MC3R相互作用;e, 单点突变对MC3R cAMP信号转导的影响;f, γ-MSH的亚型选择性。
复旦大学基础医学院博士研究生冯文博和复旦大学基础医学院青年研究员周庆同为该论文的共同第一作者;复旦大学王明伟讲席教授和中国科学院上海药物研究所杨德华研究员为该论文的共同通讯作者。该研究成果先后获得了国家自然科学基金委员会、国家科学技术部、国家卫生与健康委员会、中国科学院和上海市科学技术委员会等机构的经费资助。
全文链接:网页链接(也可后台留邮箱,获取PDF版本)
参考文献:
1. Yang, Y. & Harmon, C.M. Molecular signatures of human melanocortin receptors for ligand binding and signaling. Biochim Biophys Acta Mol Basis Dis 1863, 2436-2447 (2017).
2. van der Kraan, M. et al. Expression of melanocortin-5 receptor in secretory epithelia supports a functional role in exocrine and endocrine glands. Endocrinology 139, 2348-2355 (1998).
3. Catania, A., Gatti, S., Colombo, G. & Lipton, J.M. Targeting melanocortin receptors as a novel strategy to control inflammation. Pharmacol Rev 56, 1-29 (2004).
4. Moscowitz, A.E. et al. The importance of melanocortin receptors and their agonists in pulmonary disease. Front Med 6, 145 (2019).
5. Yeo, G.S.H. et al. The melanocortin pathway and energy homeostasis: from discovery to obesity therapy. Mol Metab 48, 101206 (2021).
6. Cai, M. & Hruby, V.J. The melanocortin receptor system: a target for multiple degenerative diseases. Curr Protein Pept Sci 17, 488-496 (2016).
7. Montero-Melendez, T., Gobbetti, T., Cooray, S.N., Jonassen, T.E. & Perretti, M. Biased agonism as a novel strategy to harness the proresolving properties of melanocortin receptors without eliciting melanogenic effects. J Immunol 194, 3381-3388 (2015).
8. Ma, S. et al. Structural mechanism of calcium-mediated hormone recognition and Gbeta interaction by the human melanocortin-1 receptor. Cell Res 31, 1061-1071 (2021).
9. Luo, P. et al. Structural basis of signaling regulation of the human melanocortin-2 receptor by MRAP1. Cell Res 33, 46-54 (2023).
10. Zhang, H. et al. Structural insights into ligand recognition and activation of the melanocortin-4 receptor. Cell Res 31, 1163-1175 (2021).
11. Dixon, A.S. et al. NanoLuc complementation reporter optimized for accurate measurement of protein interactions in Cells. ACS Chem Biol 11, 400-408 (2016).
12. Ballesteros, J.A. & Weinstein, H. Integrated methods for the construction of three-dimensional models and computational probing of structure-function relations in G protein-coupled receptors. Methods Neurosci 25, 366-428 (1995).
