


据估计非酒精性脂肪性肝炎(NASH)影响了全球1.5-6.5%的成年人群,NASH是一种进展性疾病,其中部分人群可能发展为严重的肝脏疾病,如肝硬化、肝细胞癌,甚至需要肝移植治疗的肝功能衰竭[1~5]。在过去的几十年里,无论是在发展中国家还是在发达国家,NASH的患病率都呈上升趋势,其上升与代谢综合征、血脂异常、肥胖和2型糖尿病的增加是同步的[6~7]。虽然NASH是一个全球性的健康问题,并且正在成为终末期肝病的主要原因,但目前仅Zydus Cadila旗下的PPARα/γ激动剂Saroglitazar在印度被批准用于治疗NASH,美欧日等国家和地区均未有NASH治疗药物批准上市。因此,开发有效的NASH特异性治疗方法至关重要。
近年来,NASH市场迎来了研发热潮,NASH研发管线大约有150多个,我国大约有20多家企业布局该市场。广东众生睿创生物科技有限公司在NASH治疗领域深耕,目前已布局多项不同作用机制的候选药,处于不同的研发阶段,既可以单独使用,也可以联合使用,丰富了在NASH领域的产品组合。
ZSP1601是一种泛磷酸二酯酶(PDE)抑制剂,是国内首个获得NASH的临床试验批件的首创新药,日前吉林大学第一医院研究团队在欧洲肝脏研究学会年会(EASL 2022)上口头报告了ZSP1601的顶线数据,发出了中国声音。据悉ZSP1601是中国唯一入围NAFLD治疗专题口头报告的研究(EASL 2022. Abstract OS125)。现将ZSP1601的Ib/IIa期临床试验数据简述如下。
01 研究方法
本研究为多中心、随机、双盲、安慰剂对照的早期探索性研究,研究入组了基线时磁共振质子密度脂肪含量(MRI-PDFF)≥10%且ALT≥1.5倍正常值上限的NASH确诊或表型诊断患者。36例患者纳入三个剂量组(50mg QD组、50mg BID组和100 mg BID组)和安慰剂组,共治疗4周,停药后观察2周。评估NASH患者口服ZSP1601片的安全性,表征ZSP1601在NASH患者的药代动力学特征,并通过非侵入性标志物评价ZSP1601在代谢、肝脏脂肪含量、炎症坏死和纤维化等几个重要的NASH驱动因素方面的作用。主要的探索性疗效指标是与基线相比ALT和肝脏脂肪含量(LFC)的变化。
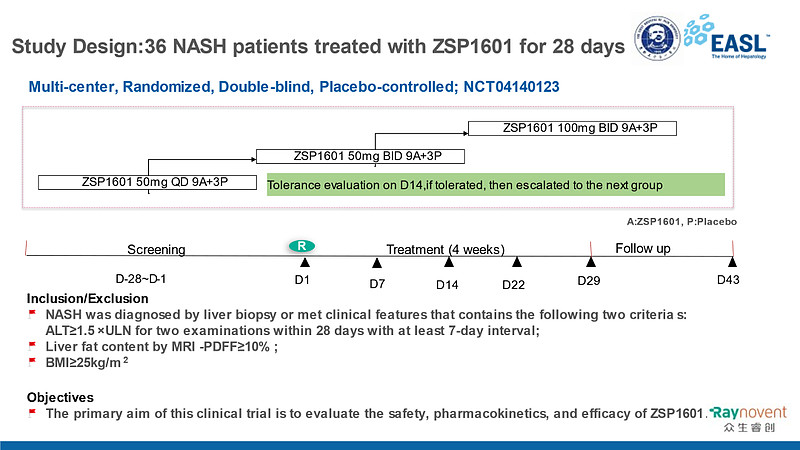
临床研究设计
02 研究结果
研究共随机入组37例NASH患者,接受给药者36例,其中27例接受ZSP1601治疗,9例服用安慰剂。除了ZSP1601 100mgBID组ALT略高外,各组人口学基线特征基本均衡可比。
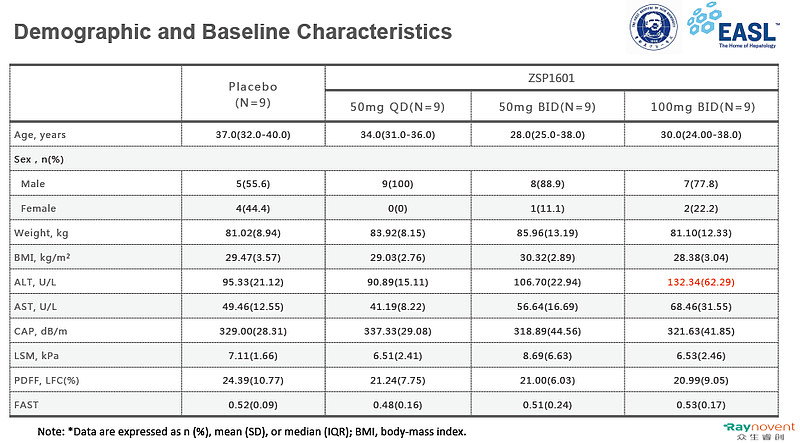
各剂量组人口基线统计学特征
安全性和耐受性
ZSP601片在NASH患者中具有良好的安全性和耐受性。ZSP1601组和安慰剂组间的不良事件、不良反应的差异均无统计学意义。大多数不良事件为1级或2级,无严重不良事件发生,未发生导致死亡的不良事件,无因不良事件停止研究用药或退出研究的情况发生。研究中ZSP1601治疗组未观察到瘙痒,LDL水平未较安慰剂组升高。
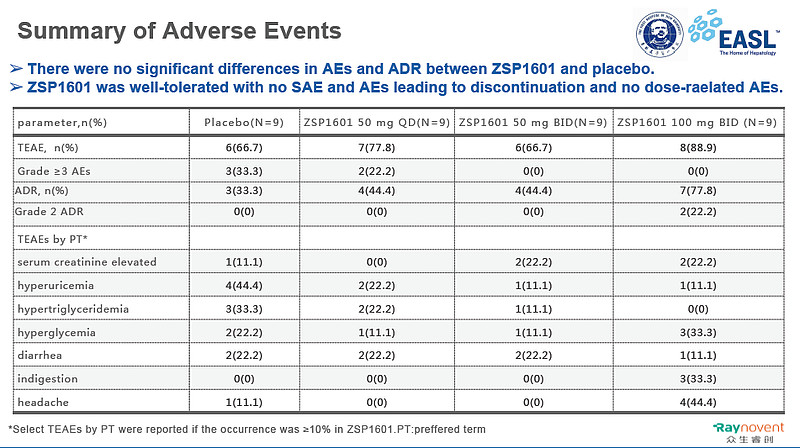
各剂量组治疗相关不良事件(发生率≥10%)比较
药代动力学特征
NASH患者连续口服ZSP1601片4周后,在50mg QD、50mg BID和100mg BID三个剂量组下,血浆暴露量随剂量增加呈递增的趋势。服药后约1.5~2.5小时达到峰值,半衰期约9小时,Ib/IIa期的药代动力学特征与Ia期健康人一致。
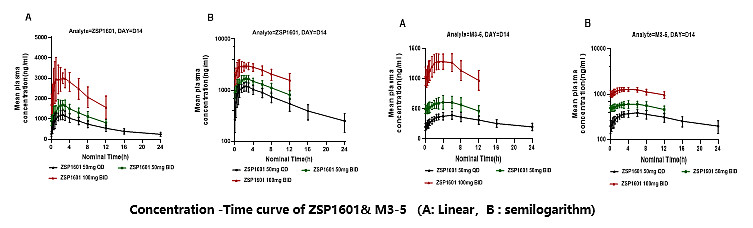
ZSP1601及其主要代谢产物M3-5药时曲线
有效性结果
接受ZSP1601不同剂量治疗28天后,在代谢、肝脏脂肪含量、炎症和纤维化生物标记物指标,均有明显的改善作用。如Fibroscan-CAP、ALT、AST、GGT、FAST等指标 ,ZSP1601治疗组与安慰剂组存在统计学显著性差异,在体重、BMI、TC、LDL-C、MRI-PDFF、CK-18、APRI等指标,与基线相比,具有统计学性显著性差异。
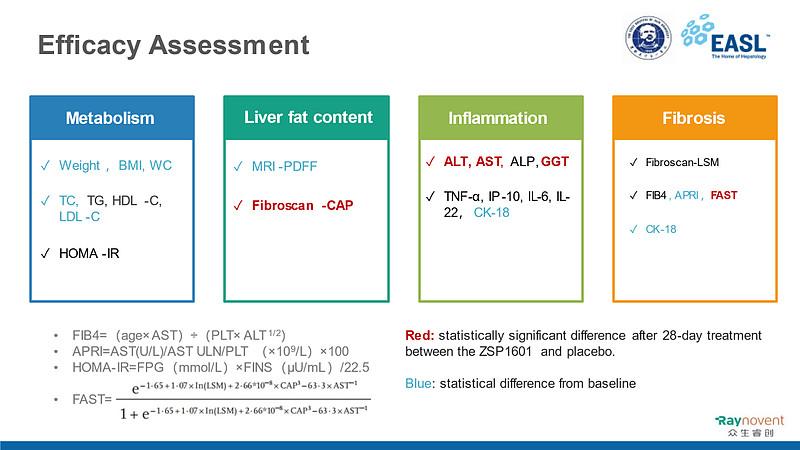
非侵入性生物标记物分析结果
ZSP1601片治疗4周,经基线调整后50mg QD组、50mg BID组和100mg BID组ALT分别较基线下降25.79 U/L、41.73 U/L和56.73 U/L,安慰剂组ALT下降17.57 U/L,中、高剂量组与安慰剂组相比差异有统计学意义(P=0.0225和P=0.0003)。ZSP1601各组ALT较基线相对分别下降20.93%、35.69%和49.03%,安慰剂组下降14.06%,中、高剂量组分别有22.2%(2/9)和44.4%(4/9)的受试者ALT恢复正常,而安慰剂组为0例。与安慰剂相比,ZSP1601高剂量组AST较基线明显下降,差异有统计学意义(P=0.0115)。与基线相比,ALT下降≥30%的例数,安慰剂组、ZSP1601 50mg QD组、50mg BID组和100mg BID组例数分别为2例(22.22%)、4例(44.44%)、6例(66.67%) 和8例(88.89%)。作为最常用的肝脏炎症损伤标志物,ALT和AST较基线明显下降,且呈现出明显的剂量依赖性,并在停止试验用药2周后出现反弹,进一步印证了ZSP1601对NASH患者的肝生化改善作用。
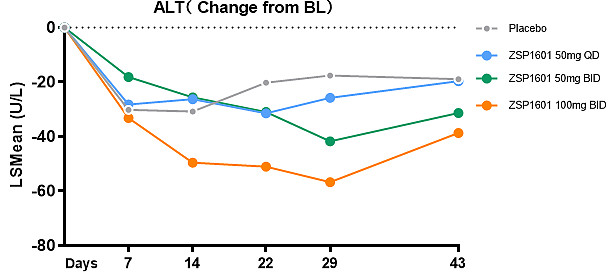
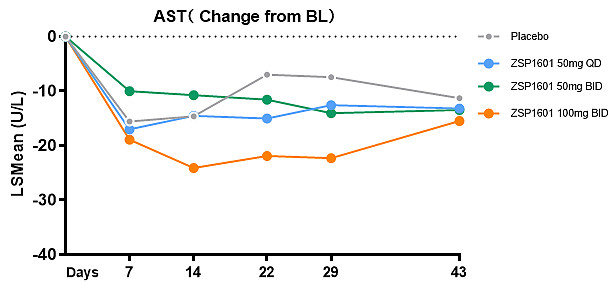
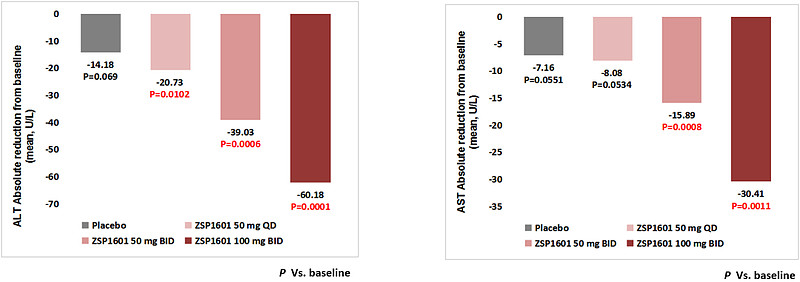
ZSP1601显著降低肝损伤标志物ALT和AST
本研究通过磁共振质子密脂肪分数(MRI-PDFF)来评估与基线相比肝脏脂肪含量(LFC)的变化。治疗4周后,ZSP1601 50mg QD、50mg BID和100mg BID组LFC相对较基线分别下降12.43%、21.88%和25.50%,安慰剂组LFC下降12.80%,较基线均有统计学差异。中、高剂量组分别有33.3%(3/9)和44.4%(4/9)的受试者LFC较基线降低≥30%,安慰剂组仅有11.1%(1/9)LFC较基线降低≥30%。
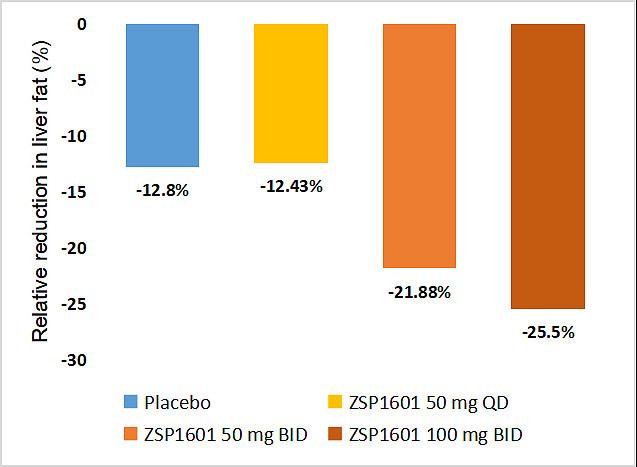
ZSP1601治疗4周后,肝脏脂肪含量较基线明显下降
此外,与安慰剂相比,ZSP1601高剂量组FAST和CAP的变化有统计学意义(P= 0.0037、P=0.0395)。ZSP1601在中、高剂量组观察到GGT、TC、APRI和CK-18较基线明显下降。各组体重、BMI和腰围也较基线下降。同时,与安慰剂组相比,ZSP1601各组并不升高LDL-C和甘油三酯水平。
研究结论
ZSP1601耐受性、安全性良好,可改善NASH患者有效性指标。支持在更大样本量的NASH患者中评价ZSP1601的长期安全性和疗效。
03 专家简评
吉林大学第一医院牛俊奇教授:目前尚无有效的NASH治疗手段,很多被寄予厚望的药物在II期和III期临床试验中由于未达到疗效终点而宣告失败。ZSP1601早期临床研究在4周的治疗后明显地降低了ALT、AST等肝脏炎症损伤标志物,肝脏脂肪含量也明显下降,提示其具有减少肝脏脂肪沉积,改善肝脏炎症、坏死的潜力,在更长的治疗周期中或可表现出抗纤维化的作用。本研究结果提示ZSP1601是一种安全、有前景的NASH治疗新药候选药物。作为国内首创First-in-Class的治疗NASH的新药,ZSP1601获得的积极结果更是鼓舞着我们持续探索,继续创新实践,在NASH治疗领域发出更响亮的中国声音。
共同主要研究者吉林大学第一医院I期临床研究室主任丁艳华教授:ZSP1601有着较好的安全性和耐受性,本研究入组的患者均为超重患者,其PK特征和Ia期健康人一致。我们探索了多种疗效指标,ALT、AST等指标在治疗4周后出现明显下降,且有明显了量效关系,显示出了ZSP1601的疗效潜能。有研究表明,ALT降低大于17 U/L与NASH患者的组织学应答有关[8~12]。值得注意的是,本研究中ZSP1601的疗效指标改善是在治疗4周后即可达到,这比其他临床试验的疗程(通常为12周以上)要短。此外,疗效分析显示,MRI-PDFF和一些非侵入性肝脂肪变性和纤维化标志物也显著降低,试验获得的积极结果超出了我们的预期。
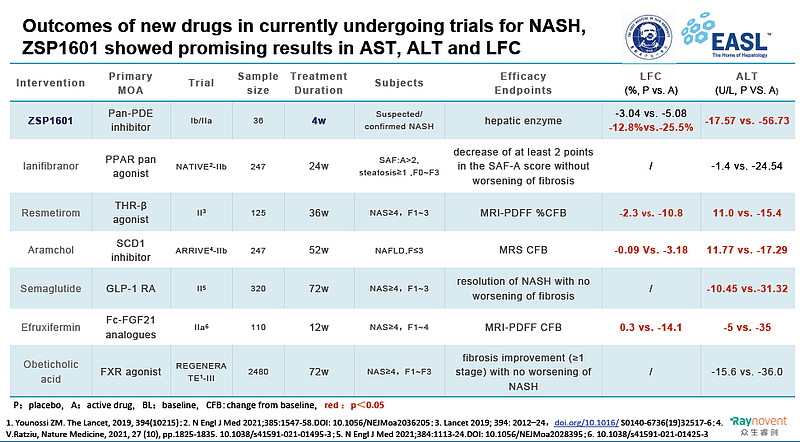
ZSP1601与其他NASH治疗药物用药后不同时间ALT、LFC对比
参考文献:
Younossi Z.M., Koenig, A.B., Abdelatif, D., Fazel, Y., Henry, L., and Wymer, M. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes. Hepatology. 2016; 64(1): 73-84. doi: 10.1002/hep.28431.
Tesfay M., Goldkamp, W.J., and Neuschwander-Tetri, B.A. NASH: The Emerging Most Common Form of Chronic Liver Disease. Mo Med. 2018; 115(3): 225-9.
Kanwal F., Kramer, J.R., Mapakshi, S., Natarajan, Y., Chayanupatkul, M., Richardson, P.A., et al. Risk of Hepatocellular Cancer in Patients With Non-Alcoholic Fatty Liver Disease. Gastroenterology. 2018; 155(6): 1828-37.e2. doi: 10.1053/j.gastro.2018.08.024.
Wong R.J., Aguilar, M., Cheung, R., Perumpail, R.B., Harrison, S.A., Younossi, Z.M., et al. Nonalcoholic steatohepatitis is the second leading etiology of liver disease among adults awaiting liver transplantation in the United States. Gastroenterology. 2015; 148(3): 547-55. doi: 10.1053/j.gastro.2014.11.039.
Satapathy S.K., and Sanyal, A.J. Epidemiology and Natural History of Nonalcoholic Fatty Liver Disease. Semin Liver Dis. 2015; 35(3): 221-35. doi: 10.1055/s-0035-1562943. Tesfay M., Goldkamp, W.J., and Neuschwander-Tetri, B.A. NASH: The Emerging Most Common Form of Chronic Liver Disease. Mo Med. 2018; 115(3): 225-9.
Kleiner D.E., Brunt, E.M., Wilson, L.A., Behling, C., Guy, C., Contos, M., et al. Association of Histologic Disease Activity With Progression of Nonalcoholic Fatty Liver Disease. JAMA Netw Open. 2019; 2(10): e1912565. doi: 10.1001/jamanetworkopen.2019.12565.
Sanyal A.J., Campbell-Sargent, C., Mirshahi, F., Rizzo, W.B., Contos, M.J., Sterling, R.K., et al. Nonalcoholic steatohepatitis: association of insulin resistance and mitochondrial abnormalities. Gastroenterology. 2001; 120(5): 1183-92. doi: 10.1053/gast.2001.23256.
Harrison S.A., Bashir, M.R., Guy, C.D., Zhou, R., Moylan, C.A., Frias, J.P., et al. Resmetirom (MGL-3196) for the treatment of non-alcoholic steatohepatitis: a multicentre, randomised, double-blind, placebo-controlled, phase 2 trial. Lancet. 2019; 394(10213): 2012-24. doi: 10.1016/s0140-6736(19)32517-6.
Newsome P.N., Sasso, M., Deeks, J.J., Paredes, A., Boursier, J., Chan, W.K., et al. FibroScan-AST (FAST) score for the non-invasive identification of patients with non-alcoholic steatohepatitis with significant activity and fibrosis: a prospective derivation and global validation study. Lancet Gastroenterol Hepatol. 2020; 5(4): 362-73. doi: 10.1016/s2468-1253(19)30383-8.
Harrison S.A., Ratziu, V., Boursier, J., Francque, S., Bedossa, P., Majd, Z., et al. A blood-based biomarker panel (NIS4) for non-invasive diagnosis of non-alcoholic steatohepatitis and liver fibrosis: a prospective derivation and global validation study. Lancet Gastroenterol Hepatol. 2020; 5(11): 970-85. doi: 10.1016/s2468-1253(20)30252-1.
Loomba R., Sanyal, A.J., Kowdley, K.V., Terrault, N., Chalasani, N.P., Abdelmalek, M.F., et al. Factors Associated With Histologic Response in Adult Patients With Nonalcoholic Steatohepatitis. Gastroenterology. 2019; 156(1): 88-95.e5. doi: 10.1053/j.gastro.2018.09.021.

版权声明/免责声明
本文为转载文章,版权归拥有者。
仅供感兴趣的个人谨慎参考,非商用,非医用、非投资用。
欢迎朋友们批评指正!衷心感谢!
文中图片、视频为授权正版作品,或来自微信公共图片库,或取自公司官网/网络
根据CC0协议使用,版权归拥有者。
任何问题,请与我们联系。