
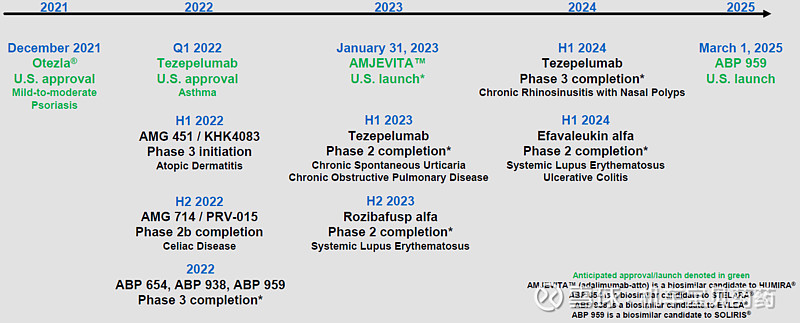
管线展望
治疗哮喘的TSLP预计2021Q1获批;AMJEVITA 是Humira的生物类似药,预计2023年在美国上市,ABP959是SOLIRIS(eculizumab,C5,Alexion)的生物类似药,预计2025年在美国上市。
公司对于免疫炎症类药物的治疗理念是通过
1)抑制免疫炎症发病机理的相关靶点;2)清除体内致病的物质及细胞;3)调节各类T细胞平衡,增强抗原特异性Treg功能及数量;4)促进细胞再生修复受损组织4个方面来重建免疫系统的平衡。
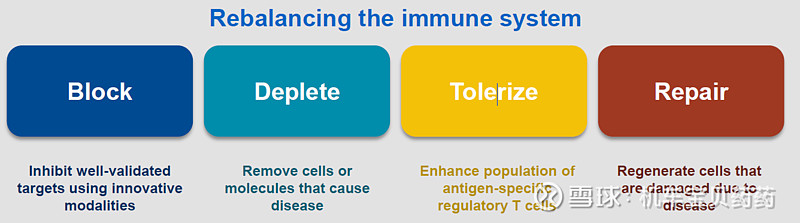
1)Blocking:最传统的方式之一,抑制相关的cytokine通路;
2)Depleting:清除相关细胞,例如OX40,根据病理和患者个体差异更个性化;
3)Tolerize:几乎所有的自身免疫炎症都和Treg调节异常有关,AMG592(IL-2 mutein,Efavaleukin alfa);
4)Repair:专家表示“barrier function is often lost in this type of disease",比如说炎症性肠病IBD的胃肠道 lining 和哮喘肺泡等表面组织都有一定的损害;公司此前收购的Rodeo公司,有一个临床前靶向15-PGDH 的品种,就是与表皮细胞再生相关的。
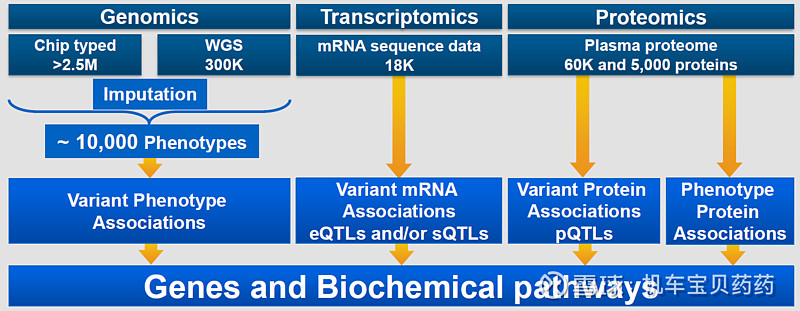
公司强调基因组学和其他组学-OMICS基础研究对于开发炎症创新药的重要性目前公司已有超过250万人的基因数据,WGS(全基因组)测序超过30万人,合计涉及1万多个表型phenotype。公司将这些Genome层面的数据将与Transciptome转录组学以及Proteome蛋白组学数据结合去研究每一个可能成药的靶点和通路。特别是现在这个时代大家都做精准疗法,这套理念适用于各类其他疾病的药物研发。
AMG451/KHK4083 OX40 单抗
第一个适应症是特应性皮炎Atopic Dermatitis,全球主要市场超过3000万患者。Th2被大量激活是AD发病的重要机理之一。OX40的表达是通过cytokine驱动的,多表达于CD4、CD8,Th1/2/17等等;并且,大部分只表达于有组织损伤/病变的皮肤(AD 患者没有lesion的部分是不表达的);可以看出这个靶点是非常有特异性(非常适合精准靶向)。OX40-OX40L是 T细胞维持、延长激活状态的关键(比如提升cytokine释放、和pro-survival信号的表达等)。
AMG451 的作用机理
1)不止可以抑制OX40的信号;
2)还可以清除表达OX40的T细胞;这是因为这个抗体药物经过了afucosylation(岩藻糖基化)修饰,可以进一步激发ADCC效应;不伤害没有被激活/表达OX40的T细胞。
临床 II 期实验设计如下
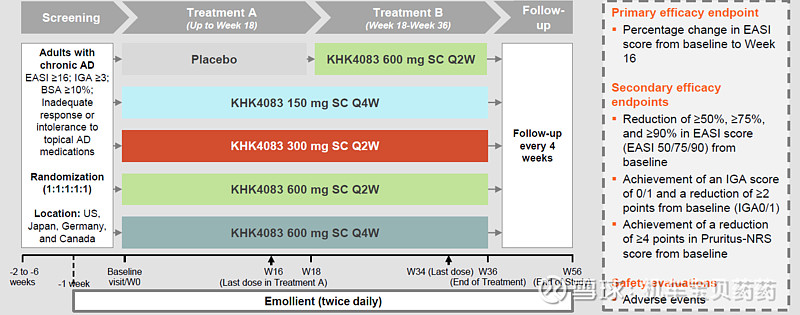
PHASE 2 STUDY DESIGN (NCT03703102)入组患者大部分都是此前用过系统性生物药的,例如dupilumab、IL-17等。
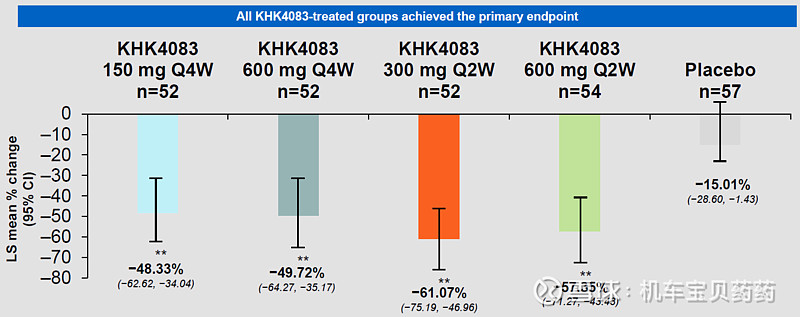
第16周的疗效
EASI-Score作为主要临床终点,是一个评估AD严重程度的综合指标。数据显示300mg每两周一次的貌似效果最好,EASI下降61.07%,安慰剂下降57.35%。此外,数据还显示:每两周一次效果比每四周一次效果好;而每次提升剂量,效果到不见得会更好,300mg和每次600mg的疗效没有剂量依赖关系。
从时间维度看疗效
检验方式:看有多少患者达到了EASI-75(简单理解为疾病得到了 75%的好转),该数据是该类药物审批的基本要求。专家表示下图说明两个重要的points:1)所有剂量的疗效跟安慰剂比都有临床显著差异;2)疗效会随着时间持续上升,特别是在前16周。
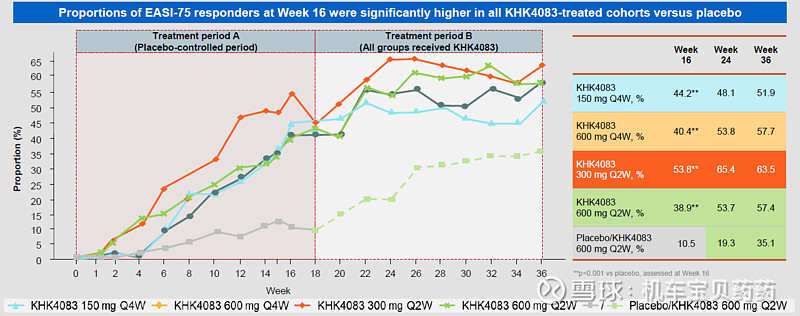
36周停药后,疗效还可以维持很长一段时间,如下图。其中绿色的是最高剂量,每两周一次,每次600mg,直到停药后的第20周都还有超过90%的人保持EASI75。即便是最低的剂量150mg每四周一次组,在第18周的时候也有超过一半的人维持疗效。300mg每两周一次组第20周的时候89%的患者维持EASI75。考虑到该类疾病在完成基础疗程之后可能需要进入维持治疗阶段,这个阶段注射的频率可以大幅降低。

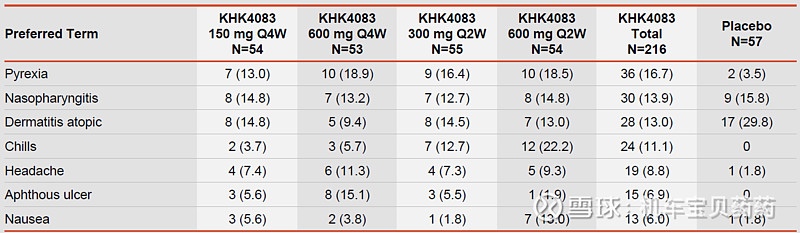
安全性
最常见的副作用就是发热、打喷嚏什么的,都是1~2级的,而且基本上都是第一针出现这些问题,当天消除,后面就再不会发生了。最主要的停药原因倒不是什么别的副作用,而是可能没疗效AD又加重了,这个安慰剂组是实验组的2~3倍左右
Tezepelumab(TSLP)用于治疗重症哮喘的抗体药物
未被满足的临床需求
现在虽然有一些已上市的生物药,但是大约有一半的患者无法得到比较全面的病情控制,一年之内还是会有病情加重需要进急诊情况。目前约有一半的重症哮喘患者的发病原因与免疫炎症有关。同样也是有差不多一半的患者Eosinophil嗜曙红细胞<300cell/uL,这部分患者对现在已上市的一些生物药应答不理想。
哮喘从病例角度大约分为3种
过敏性:循环系统出现大量IgE,可用抗IgE抗体;嗜曙红细胞性EOS:血液中嗜曙红细胞数量大幅提升,现有抗IL-5抗体可以控制;非嗜曙红细胞性Non-EOS:血液以及粘膜中嗜曙红细胞数量正常,传统治疗手段,例如LAMA等。
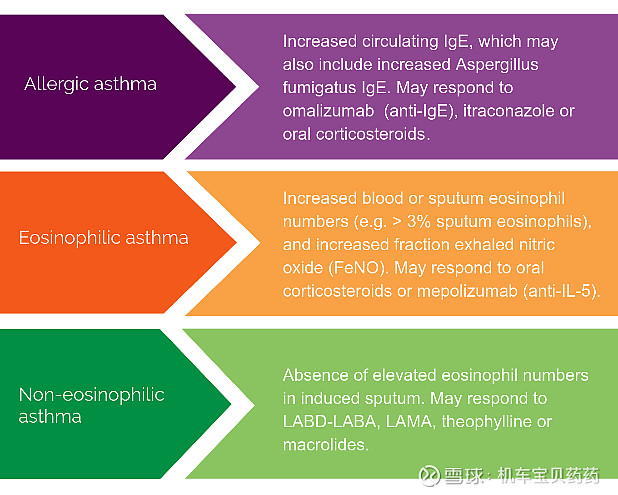
非嗜曙红细胞性哮喘中又包括嗜中性粒细胞性哮喘Neutro,顾名思义嗜中性粒细胞增多,这类占重症哮喘大概10~15%。专家表示,现在越来越多研究发现很多患者并不是非EOS即Neutro,而是两种性质都有一点,Th1和Th2也都一样有一点。2者有可能是同时提升,也有可能是交替提升。所以如果有一个药可以同时搞定这两种病例,就很棒!
TSLP属于一种alarmin,是一个关键的上皮细胞炎症因子,在整个哮喘发病MOA通路的最上游。TSLP会触发过敏反应、嗜曙红细胞性炎症以及非Th2炎症。反应过度就变成了哮喘。
注:Alarmins are endogenous, constitutively expressed, chemotactic and immune activating proteins/peptides that are released as a result of degranulation, cell injury or death or in response to immune induction.
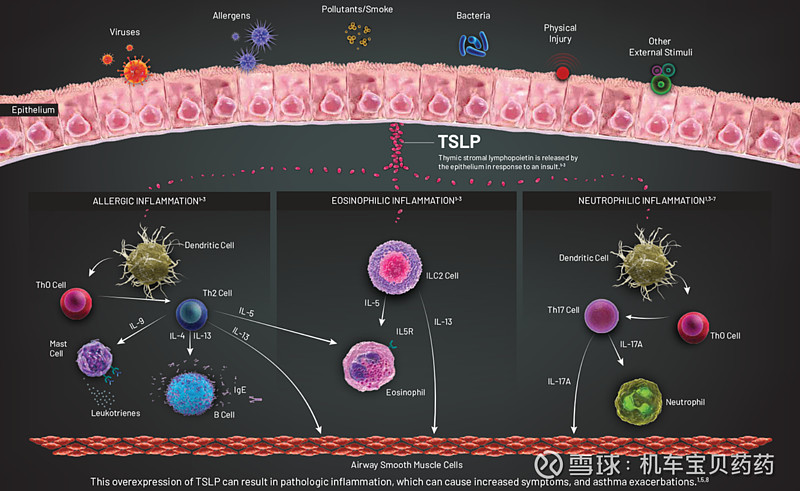
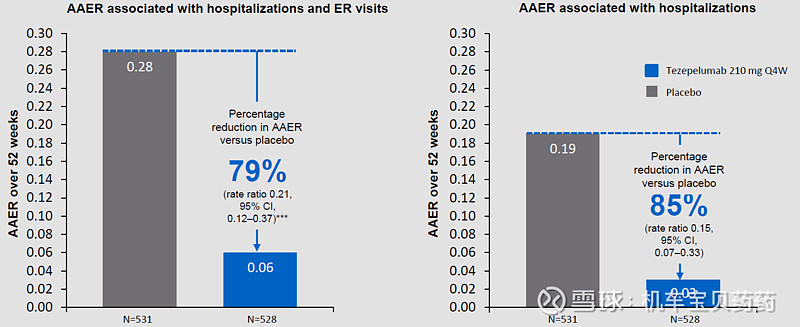
正因为TSLP处在发病机制的上游,tezepelumab才可以对多种类别的哮喘都有疗效。III期临床数据显示,EOS大于或小于300疗效都非常显著,Annualized Asthma Exacerbation Rates (AAERs,年加重率)较安慰剂分别下降70%和41%;如果只看住院率+急症率或住院率,效果就更明显了,分别下降79%、85%。
该品种预计2022Q1获批,未来有望成为哮喘的一线疗法。从商业化的角度来看,美国大约有100万的受众群体(美国一共2600w哮喘患者,其中420w属于重症哮喘,其中大约100w适合用tezepelumab,其中一半都是lowEOS)。公司强调,该品种是与阿斯利康合作开发的,AZ在呼吸系统领域是全球领导者,已经做50多年了。
AMG714(IL-15抗体)治疗Celiac Disease乳糜泻;脂泻病
乳糜泻患者对麸质(麦胶)不耐受引起小肠粘膜病变为特征的一种原发性吸收不良综合征,会腹泻。除麦胶直接毒性外,还有可能很大一部分患者是因为先天基因缺陷导致的自身免疫炎症,这部分患者就算不吃gluten也会发病,称之为Nonresponsive celiac disease(NRCD)。
流行病学:全球0.7%的成人会有CD,其中30%属于NRCD,也就是说差不多1600w患者。而目前竟然并无专门给治疗NRCD的药物。
发病机理之一:肚子里的某些T细胞莫名活跃,例如cytotoxicT、NK等。IL-15在CD的肚子中高表达,并且还会抑制这些细胞自杀凋亡,所以炎症相关的淋巴细胞开始聚集。抑制IL-15可以让炎症相关细胞重新开始凋亡。
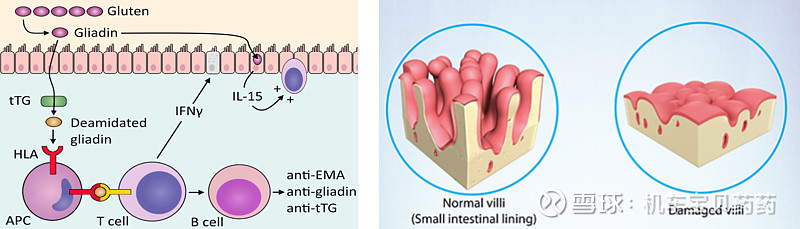
临床2a期研究做了gluten-challenge(挑战试验,就类似打疫苗挑战实验,直接往肚子里面灌gluten,看看还会不会发病),得到了POC。目前该品种那个在临床2b期招募中。
其余品种:两个治疗SLE的品种系统性红斑狼疮
Efavaleukin Alfa (IL-2 mutein):用于治疗SLE,过去的40年里只有2个药获批。SLE其中一个发病机制是Treg和Teff二者失衡,该品种可以提升体内Treg数量。以前有一些试验证实往体内注射低剂量的IL-2可以提升Treg的数量,但是继续提升剂量Teff的数量也开始提升,又失衡了。所以公司做了这个IL-2 mutein,就是改变了一些氨基酸序列,变异蛋白,解决掉Teff数量提升的问题。Rozibafusp Alfa(BAFF ICOSL 双靶融合蛋白)
加小编微信yunmeimei002入群交流海外医药