
2024年5月31日
医麦客新闻 eMedClub News
CAR-T细胞疗法已经在血液瘤中取得了革命性的治疗成果,当下CAR-T细胞治疗赛道机遇与挑战并存,红海和蓝海竞拓。一方面,已公布的海外上市CAR-T细胞治疗产品的2023年销售总额达到37.14亿美元,同比增长超过37%,逐年递增的销售总额折射出市场对CAR-T细胞治疗的认可,未来有望在成本降低和产能提升的基础上加速放量。
另一方面是CAR-T细胞药物开发的竞争白热化。美国临床试验数据库Clinicaltrials显示,中国CAR-T细胞临床研究数量超过600项,居世界首位。研发数量之多,靶点、适应症之集中也倒逼企业去探索CAR-T细胞治疗更广阔的领域。
其中,随着研究的深入和临床数据的支撑,一条憧憬着希望的道路逐渐清晰——自身免疫性疾病。
目前,自身免疫性疾病的病因和发病机制尚不完全清楚,病情具有复杂性和多样性,尚无根治药物。尽管传统的糖皮质激素和免疫抑制剂一定程度上能够控制疾病发展,但这些药物长期使用耐受性较差,并有可能带来一系列的不良反应。因此,仍亟需新的安全有效的治疗方式以满足未竟临床需求。
已报道的诸多研究表明,CAR-T细胞在治疗自身免疫性疾病上具有极高的潜力。目前,全球已有多家CAR-T治疗企业率先在自身免疫性疾病领域进行布局,并已进入到注册性临床阶段。
国外进展较快的企业如Cartesian,其开发的BCMA靶向CAR-T细胞药物针对全身性重症肌无力的临床研究已经推进至2期;Kyverna开发的KYV-101已经斩获了多个针对自身免疫性疾病的IND,并于今年2月成功登录纳斯达克。同时,如Novartis, BMS等巨头企业,也相继开展了CAR-T治疗自免疾病的临床试验。国内如药明巨诺、驯鹿生物、亘喜生物、西比曼、邦耀生物、瑞顺生物等企业也抢先布局了这一领域,并有多家进入临床试验阶段。
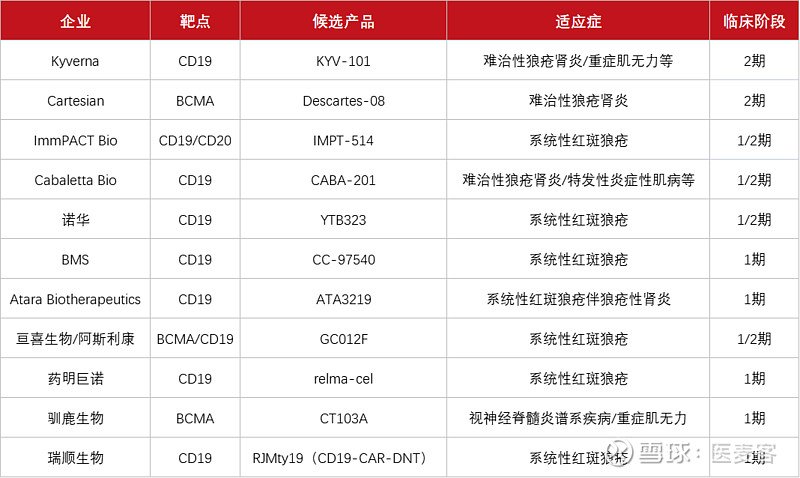
▲全球进入临床阶段的自免CAR-T企业及
候选产品(图片来源:医麦客整理)
根据弗若斯特沙利文的测算,预计至2030年,全球针对自身免疫性疾病的生物药市场规模将达到1450亿美元[1],有望成为继肿瘤后的下一大市场,这给CAR-T细胞治疗留下了广阔的想象空间。
疗效与安全性俱佳,
国产CAR-T治疗SLE潜力迸发
eMedClub
在针对自身免疫性疾病的布局中,系统性红斑狼疮(SLE)是众多入局者青睐的适应症之一,有可能率先取得突破。国内CAR-T细胞治疗第一梯队企业药明巨诺,可以说是CAR-T治疗SLE领域的先行者。
2023年4月,药明巨诺自主开发的自体CD19 CAR-T细胞治疗产品瑞基奥仑赛注射液(relma-cel)用于治疗中重度难治性SLE的新药临床试验申请(IND)获得国家药品监督管理局(NMPA)的默示许可,成为国内首个,这也是瑞基奥仑赛在非肿瘤领域开拓探索的一个重要里程碑。
在近期举办的欧洲风湿病学(EULAR)大会上,药明巨诺公布了瑞基奥仑赛注射液在中国成人活动性SLE患者中的最新临床研究数据。目前该报告摘要已经在EULAR网站展示。

这一数据来自一项在中国开展的单臂、开放、多中心剂量探索研究[NCT05765006],入组受试者接受了25×106(25M)、50×106(50M)、75×106(75M)或100×106(100M)剂量的CAR-T细胞静脉输注。
根据官方公布的资料显示,截至2024年4月8日,12例已入组的受试者完成了瑞基奥仑赛注射液回输,初步完成了低、中、高剂量组的安全性、药代和药效动力学(PK/PD)以及疗效探索,最长随访时间已超过9个月。在这12例患者中,11例患者在回输后可停用传统的激素、免疫抑制剂等药物,且绝大部分患者的器官损伤情况也观察到了明显的改善。
在已有至少3个月疗效数据的患者中(25M/50M/75M剂量组各3例),达到SLE应答指数4(SRI-4)指标的比例为100%。其中,4例患者随访至6个月仍100%达到SRI-4指标,说明瑞基奥仑赛对于中重度SLE患者带来的缓解是深度且持久的。
在安全性方面,所有剂量组的患者均呈现良好的安全性和耐受性,没有出现3级及以上神经毒性,仅2例患者出现3级感染,且所有不良事件均能在经过相应治疗后恢复。
值得特别注意的是,25M剂量组的3例活动性SLE女性成年受试者在接受了单次瑞基奥仑赛输注后,在4个月随访时,她们的SELENA-SLEDAI评分由基线8~14分降至0或1分,且均达到SRI-4指标。其中2例受试者达到更为严苛的狼疮低疾病活动度状态(LLDAS),且至数据截止日均未再使用激素及免疫抑制剂等SLE治疗药物(如下图)。目前,这3例受试者的随访时间均已经超过6个月,其疾病活动度及临床症状仍在改善中。
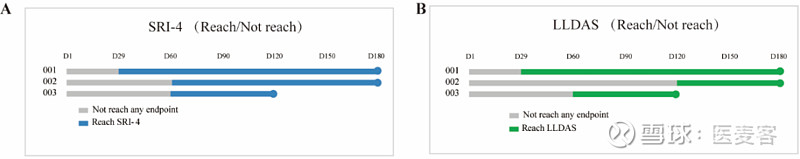
这表明,即使在相较血液肿瘤适应症极低的剂量下(约为四分之一),单次回输仍能使中重度SLE患者获得较为深度且持久的疾病缓解。
目前,这项临床研究还在进行中,以积累更多患者更长随访时间的数据。值得一提的是,该研究是现有基于已获得/公开的临床试验数据的针对SLE适应症的CAR-T治疗临床研究中,入组患者例数最多、随访时间最长的一项,因此其所提供的疗效、PK/PD和安全性数据具有重要意义,也为瑞基奥仑赛在治疗SLE方面的进一步开发和临床应用提供了强有力的支持。
首发产品双管齐下,多元化管线后劲十足
eMedClub
作为一款已上市的CAR-T细胞治疗产品,药明巨诺正不断拓展瑞基奥仑赛注射液的潜在增长点,采用了血液瘤和自身免疫性疾病“双管齐下”的策略。
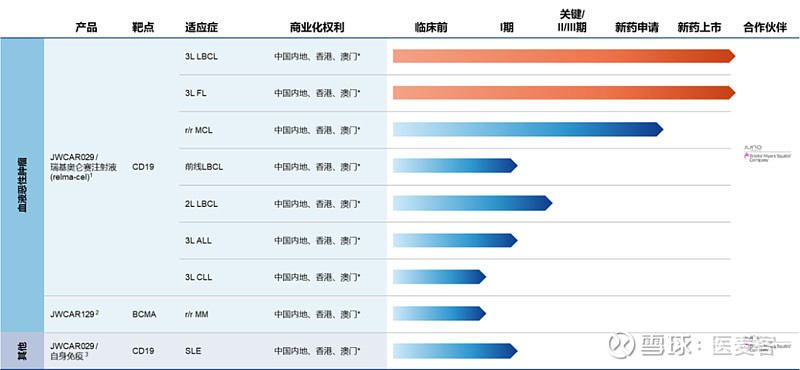
▲血液瘤管线一览(图片来源:药明巨诺)
在血液瘤领域,一方面药明巨诺积极推进瑞基奥仑赛注射液的提线治疗,在获批复发或难治性大B细胞淋巴瘤(r/r LBCL)的三线治疗后,又相继推动针对LBCL的二线和一线治疗的临床研究。CAR-T产品的提线治疗是已经经过验证可行的方式,有望取得更优的治疗效果,并且可以成为无法从标准化疗中获益的患者的新选择。
另一方面,药明巨诺正不断扩展瑞基奥仑赛在血液瘤领域的适应症。
早在2022年,该产品斩获了用于治疗经过二线或以上系统性治疗的成人难治性或24个月内复发的滤泡性淋巴瘤(r/r FL)的批准,今年1月用于治疗复发或难治套细胞淋巴瘤(r/r MCL)的上市许可申请获得NMPA受理,并已经获得治疗r/r MCL的突破性治疗药物认定及优先审评资格,有望成为国内首个用于治疗这一适应症的细胞治疗产品。
可见,药明巨诺正促进瑞基奥仑赛注射液在血液瘤中的商业化价值进一步扩大,既挺进前线治疗以期满足在早期治疗阶段未被满足的医疗需求,又不断拓展细分适应症种类,使更多患者能够从中获益。据公司去年财报披露,2023年全年共开具了184张瑞基奥仑赛注射液处方,并完成了168例回输,在商业化端取得了进一步进展。
在自身免疫性疾病领域,此次公布的IIT数据初步表明了瑞基奥仑赛注射液在SLE中颇具应用前景,且作为首个在SLE治疗领域获批IND的商业化CAR-T细胞疗法,凭借已上市优势,未来瑞基奥仑赛注射液有望快速推进至BLA阶段。同时,药明巨诺已与2seventy bio(现归属于再生元)就开发自身免疫疾病CAR-T细胞治疗产品达成了独家战略合作,这无疑加速了药明巨诺深化其细胞治疗产品开发能力的步伐,也有助于推动该款CAR-T治疗产品未来走向更加广阔的海外市场,使其商业化前景具备更大的想象空间。
除此之外,药明巨诺还建立了多元化的实体瘤管线,选择了GPC3、AFP、MAGE-A4、DLL3等具有潜力且差异化的靶点,适应症涵盖了包括肝细胞癌、肺癌在内的中国高发肿瘤类型,并且使用经过工程化的修饰元件来增强CAR细胞的杀伤活性,可持续发展动力十分强劲。
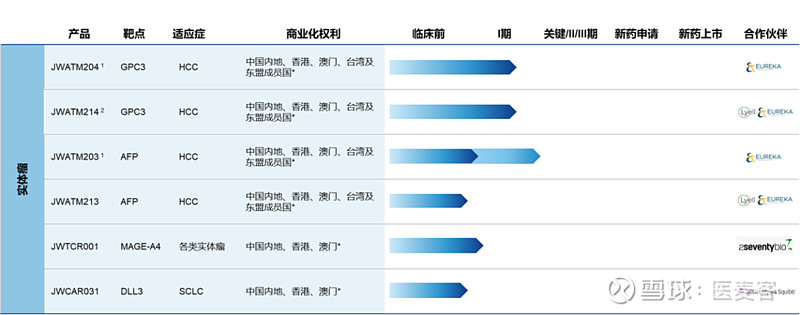
▲实体瘤管线一览(图片来源:药明巨诺)
逐梦蓝海,引领未来
eMedClub
自身免疫疾病作为CAR-T细胞治疗的一个新兴且充满潜力的“蓝海”领域,存在大量未满足的临床需求,正展现出巨大的市场价值。随着科学研究的深入和临床数据的不断积累,CAR-T细胞疗法在自身免疫疾病治疗中的应用将变得更为广泛和成熟,将可能为患者带来更多治疗选择。
同时,CAR-T细胞治疗产品已在肿瘤领域中打通了产业化及其监管路径,这将为自身免疫疾病的CAR-T细胞疗法提供有益的借鉴和参考,从而加快上市速度和推广速度。未来,这个赛道必然越发展,越快速,越创新。
参考资料:
1.东方证券《2023年自身免疫疾病行业研究报告:自免药物空间广阔》
(网页链接)
声明及版权说明
声明:本文旨在于传递行业发展信息、探究生物医药前沿进展。文章内容仅代表作者观点,并不代表医麦客立场,亦不构成任何价值判断、投资建议或医疗指导,如有需求请咨询专业人士投资或前往正规医院就诊。
版权说明:本文来自医麦客内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台,转载授权请在文章下方留言获取。