2024年4月30日
医麦客新闻 eMedClub News
近期,生命科学领域的全球性公司IQVIA发布了一份关于细胞和基因疗法现状及未来发展趋势的研究报告。
该报告指出,细胞和基因疗法(CGT)为那些缺乏其他治疗选择的患者带来了革命性的益处,近年来该领域的投资、临床研究以及新产品上市均呈现出显著增长。同时,报告还深入剖析了影响该领域未来发展的八大关键因素。
接下来,本文将详细介绍这份报告的核心内容,以便读者更好地了解该领域的最新进展和发展趋势。

据IQVIA报告统计,相较于10年前,细胞和基因疗法领域的交易规模增长了48%,并在生命科学整体交易中的占比逐年攀升。特别是在2023年,该领域的交易占比已突破10%,而在2014年,这一数字仅为5%。这些数据充分反映了业界对细胞和基因疗法治疗模式的信心与浓厚兴趣。

细胞和基因疗法领域交易数目和占所有生命科学交易的比例在过去10年里显著提升(图片来源:IQVIA官网)
经过持续的努力与创新,产业界的临床开发活动已迈上新的高峰。报告指出,过去5年中总计3285项临床试验启动,评估细胞和基因疗法在不同类型患者中的作用。在2023年,631项临床试验启动。其中生物医药公司启动的临床试验占比64%。产业界启动的临床试验的数量在过去10年中大幅度提升,与2013年相比提高了276%,与5年前相比提高了34%,并在2023年达到新高。

生物医药公司启动的细胞和基因疗法临床试验在过去10年里大幅度增加(图片来源:IQVIA官网)
这些临床试验的增加主要来自CAR-T细胞疗法的临床试验,值得一提的是,在2023年,生物医药公司启动的CAR-T疗法临床试验的占比与2022年相比有所下降,而基因疗法的占比从2022年的14%提高到22%,显示了行业聚焦领域转移的迹象。
在治疗领域方面,CAR-T疗法的主要治疗领域仍然为血液癌症和实体瘤,不过虽然靶向自身免疫性疾病的临床试验不多,但近期的研究结果显示了CAR-T疗法在这一领域的潜力。今年2月,在《新英格兰医学杂志》上发表的一项研究中(doi: 10.1056/NEJMoa2308917),CD19靶向CAR-T细胞疗法让100%的自免患者获得缓解并持续停止使用免疫抑制药物。研究中的患者包括系统性红斑狼疮、特发性炎性肌炎和系统性硬化症患者。

热议话题
遗传性疾病的基因治疗新时代
基因疗法的创新趋势与商业转化
国内首个3期B型血友病AAV基因疗法的临床进展
基因治疗的创新设计与开发策略
下一代AAV基因治疗药物开发策略
不同DMD靶点的基因编辑治疗策略
慢性疾病基因治疗:表观遗传精准调控
靶向端粒机制的衰老疾病基因治疗药物开发策略
mRNA/LNP介导体内基因编辑的递送策略
基因疗法的创新趋势与商业转化
非病毒载体基因疗法开启基因治疗2.0
第5代慢病毒载体介导的体内基因疗法治疗神经纤维瘤
体内基因编辑递送疗法的机遇与挑战
扫码
限时领取
免费门票

合作热线

18701871600(王经理)
15572286596(袁经理)
15221150919(和经理)
基因疗法治疗的疾病领域更为多样化,其中治疗实体瘤的临床试验占比35%,此外,神经疾病、代谢、内分泌、心血管和眼科疾病领域均有显著临床开发活动。基因疗法往往用于治疗遗传病,并给可能面对终身残疾威胁的患者带来希望。比如,今年初,礼来公司和复旦大学的研究团队分别报告了各自的基因疗法治疗遗传性耳聋儿童的临床试验结果。在两项临床试验中,接受基因疗法治疗的儿童的听力都获得显著改善。
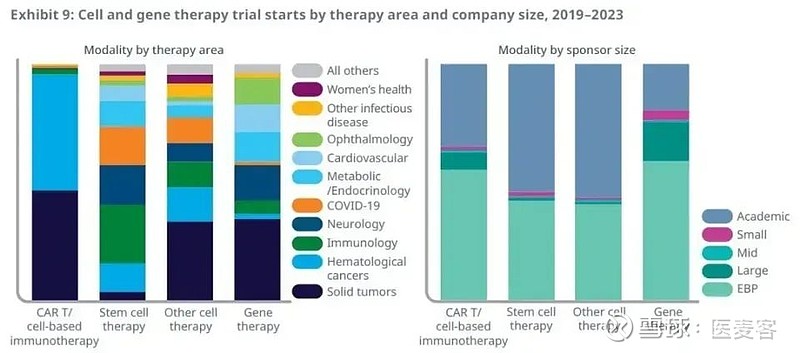
临床期细胞和基因疗法治疗的疾病领域以及启动这些临床试验的机构分类(图片来源:IQVIA官网)
大型医药公司所启动的临床试验占总数的6%,其中绝大多数聚焦于细胞和基因疗法领域。随着全球监管机构对产品上市的加速推动,获批疗法数目实现翻倍增长。
根据报告数据,截至2023年底,全球范围内已有76款细胞和基因疗法获得监管机构的批准上市,与2013年的总数相比实现了翻一番的增长。在过去的三年中,20款新的细胞和基因疗法成功获得批准。
在这些已获批的疗法中,CAR-T疗法和其他基于细胞的癌症免疫疗法在过去的十年中取得了显著的进展,截至2023年底已有12款相关疗法获得批准。同时,全球范围内共有19款基因疗法获批,主要用于治疗各类遗传性疾病。
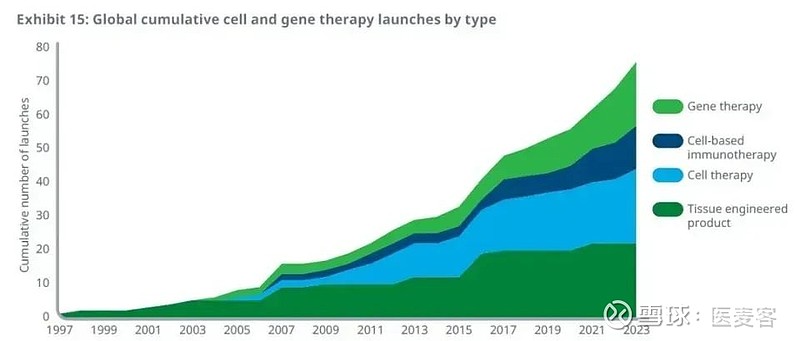
全球获批细胞和基因疗法数目和疗法类型(图片来源:图片来源:IQVIA官网)
在2023年,多款获批的细胞和基因疗法代表着针对疾病领域的重大突破。比如,首款治疗1型糖尿病的细胞疗法获得批准。首款治疗杜氏肌营养不良的基因疗法获得批准。在2023年,首个可重复给药的基因疗法也获得美国FDA的批准上市。
在监管审评领域,鉴于细胞和基因疗法研发活动的日益广泛,全球监管机构正积极采取新措施以促进研发项目的推进和评审效率。以美国为例,据IQVIA报告统计,过去五年内获得批准的细胞和基因疗法中,高达86%的项目至少获得了一种FDA加速研发的资格认定。其中,71%的疗法被授予突破性疗法认定,64%的疗法则获得了快速通道资格,均显著超过非细胞和基因疗法的比例。这些数据充分表明,细胞和基因疗法通常针对的是那些严重且具有显著未满足医疗需求的疾病领域。

2019-2023年获批上市的细胞和基因疗法(CAGT)与非细胞和基因疗法(non-CAGT)的特征(图片来源:IQVIA官网)
此外,美国FDA还推出了再生医药先进疗法(RMAT)认定制度。对于符合该认定的项目,FDA将同时提供快速通道资格和突破性疗法认定的支持。
在全球范围内,其它监管机构也为细胞和基因疗法的开发提供了加速渠道,比如欧洲药品管理局(EMA)的PRIME认定,加速评估和有条件上市,澳大利亚监管机构的优先审评和有条件批准,日本监管机构的SAKIGAKE认定。
细胞和基因疗法的未来
报告指出,细胞和基因疗法在过去10年里已经获得了长足的进步,不过这一产业与小分子药物和抗体领域相比,仍然处于未成熟阶段,未来的发展仍然存在很多不确定性。细胞和基因疗法产业的未来发展依赖于产品研发活动、监管批准、患者可及性、疗法的长期疗效和安全性等8个指标的进展。

评估细胞和基因疗法未来发展的8个指标(图片来源:IQVIA官网)
2023年,细胞和基因疗法的获批数量达到了前所未有的高度。报告预测,随着监管审评流程的持续优化以及细胞和基因疗法在肿瘤学之外的应用潜力逐渐显现,未来全球每年有望批准超过12款的细胞和基因疗法产品。其中,预计将有半数以上的疗法应用于肿瘤学以外的疾病领域,有望为超过1万名患者带来福音。
当前,细胞和基因疗法正日益受到广泛关注和深入研究,人们对其在医疗领域的潜力和前景持乐观态度,并对此充满信心。细胞和基因疗法领域的初步成果及其在临床实践中的持续成功,为众多大型医药企业带来了吸引大量投资的机会,进而推动了该领域的持续创新。
为紧抓行业当下面临的机遇,推动行业共同发展。医麦客将于2024年6月14-15日在南京举办2024 IBI EXPO生物创新药产业大会,并召开多场细胞与基因疗法论坛。本次会议将邀请该领域的先锋与领袖,聚焦最新研究动态与进展,深度探讨和展望细胞与基因药物开发的未来发展趋势。
//
2024 IBI EXPO 日程一览


扫码
限时领取
免费门票

声明:本文旨在于传递行业发展信息、探究生物医药前沿进展。文章内容仅代表作者观点,并不代表医麦客立场,亦不构成任何价值判断、投资建议或医疗指导,如有需求请咨询专业人士投资或前往正规医院就诊。

点点“分享”、“点赞”和“在看”,给我充点儿电吧~