
2024年3月12日
医麦客新闻 eMedClub News
mRNA药物作为现代医学领域的“万能钥匙”,在2021年缔造了千亿医药神话,为多种疑难病症的治疗开辟了新途径,有望继小分子和抗体药物之后成为第三类主要药物。当前,mRNA技术已成为国际药企竞相追逐的焦点,涉及肿瘤疫苗、基因编辑、CAR-T细胞治疗、蛋白替代疗法及传染病疫苗等多个领域,并已逐步成熟且有产品问世。龙头企业Moderna研发的RSV疫苗(mRNA-1345)有望今年上市,mRNA肿瘤疫苗(mRNA-4157)、季节性流感疫苗(mRNA-1010)两款重磅产品也将在近几年逐步迈入商业化,这也将开启mRNA药物研发的新浪潮。
下游市场的蓬勃发展也会带动上游市场的需求增长,尽管中国在mRNA技术方面已取得了显著进展,并有产品问世,但由于起步较晚,该产业在关键技术上仍面临挑战,欧美国家在mRNA技术领域构建了密集的专利网络,特别是在加帽和包封技术方面,这对中国的技术发展构成了一定的限制。因此,我们必须高度重视mRNA技术背后的专利布局。
Trilink专利在国内获批,
国内mRNA技术迎来新变局
eMedClub
mRNA加帽是mRNA合成过程中的一个重要步骤,目前两种主要的mRNA加帽方式是共转录加帽和酶法加帽。共转录加帽使用化学合成的帽类似物,在转录过程中直接将其添加到新生的mRNA链5'端。酶法加帽则是一种在mRNA合成后使用酶促反应来添加帽结构的方法。
共转录加帽的优点在于它可以在转录过程中直接完成加帽,从而简化了mRNA的生产过程。然而,这种方法使用的帽类似物及其对应技术却受专利保护,当下共转录加帽的核心技术和专利掌握在生物技术公司Trilink的手中,相关专利近日在国内获批。
Trilink公司本次在国内获批专利的名称为“用于合成5’-加帽RNA的组合物和方法”, 其美国同族专利已经授权,保护范围基本上与原始公开的范围相同。可以看到,该专利保护了一个类似通式化合物的加帽核苷酸引物,通过各种取代基、数字范围的限定,保护了很宽的范围,令使用方很难规避。
▲Trilink专利——用于合成5’-加帽RNA的组合物和方法
如专利所示,除了通式之外,该专利还列出了多个具体实例,这些具体的实例界定范围非常广。在这些具体的实例中有Trilink的多款拳头产品,这意味着诸多mRNA企业都会受到该专利的制约。
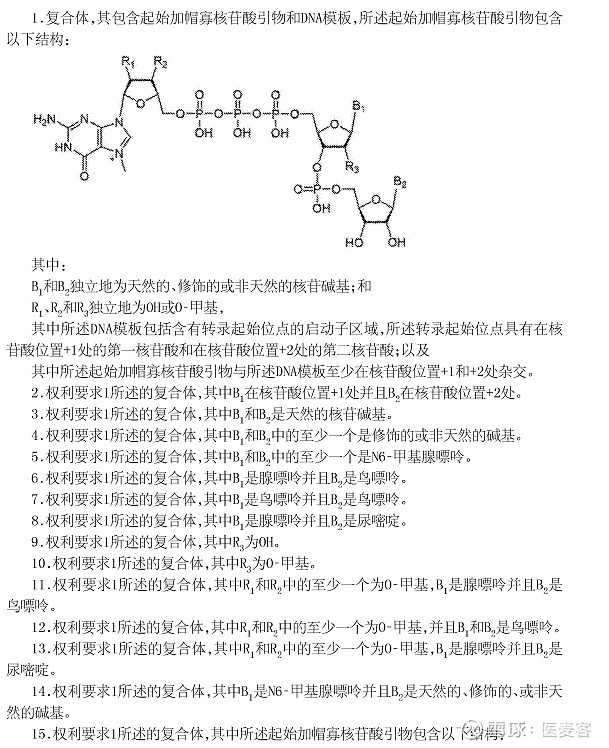
▲不同复合体范围
据统计,核苷酸及帽类似物在mRNA的生产中,成本占比超过40%,加之专利费用,国内mRNA企业如果想要基于共转录方式加帽进行相关产品开发,无疑难上加难。而突破专利壁垒形成自主知识产权,则需要更多时间、资本和技术的积淀。
绕开专利,创新酶法加帽大有可为大
eMedClub
众所周知,传统酶法加帽并不受专利限制,且加帽成功率高。但需要在体外转录(IVT)后纯化才能进行加帽反应,相对繁琐。
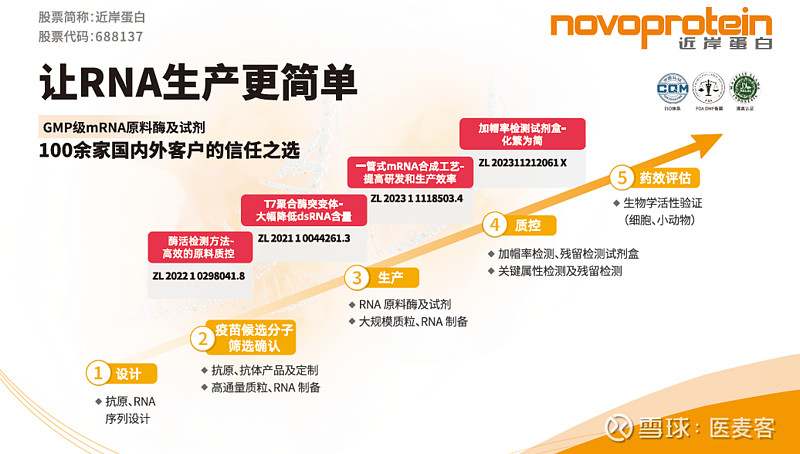
但如果能够优化这一工艺流程,使之更加简便、高效,无疑会让酶加帽法成为Trilink专利包围下的一道亮光,让更多mRNA企业多一道可选项!近岸蛋白自主研发的“一管式”高效mRNA合成工艺(发明专利号:ZL 2023 1 1118503.4)正是瞄准了这一痛点,它减去了传统工艺中在加帽前的两步纯化环节,在IVT后直接补料进行加帽,可以大大提高mRNA的生产效率,也节省了纯化成本。
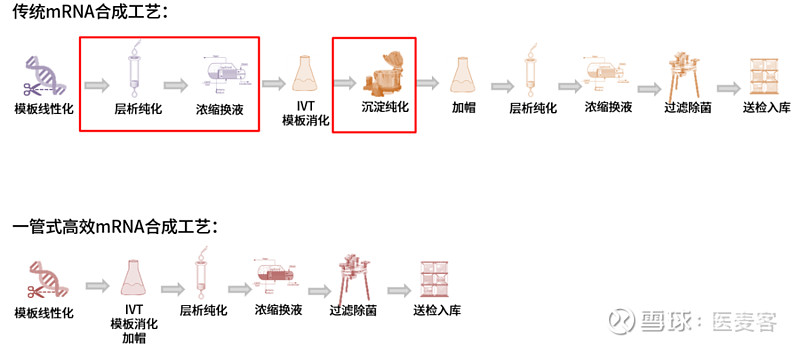
▲ 图例:一管式高效mRNA合成工艺相较于传统工艺的优势
“一管式”工艺带来的好处还远不止于此,工艺步骤的简化就像推倒了第一块多米诺骨牌,会引发一系列的连锁反应。比如,纯化步骤导致的产量损失得到降低,加上分批补料工艺,转录产量能够显著提升;同时又避免了纯化过程中RNase的污染风险,使得mRNA完整性能超过90%(毛细管电泳检测);同时,基于酶法加帽的优势,和特殊缓冲液的优化,加帽率大于95%。
如此一来,是时候打破过往对酶加帽法的“偏见”了。当下,降本增效已成为国内生物创新药产业发展的一大主旋律,对mRNA赛道来说也不例外。近岸蛋白“一管式”的mRNA合成工艺可以说正正击中了行业发展需求。
其实在mRNA技术的产业化应用中,企业遇到的阻力与挑战还有许多,比如质量控制环节的检测要点多、流程复杂耗时长、且成本较高。一方面需要从上游工艺与原料进行优化,减轻下游纯化压力;另一方面也需要更高效更灵敏的检测方法。
就前面谈到的加帽来说,加帽率是一项必不可少的关键质量属性分析对象。然而加帽与未加帽的mRNA仅有一个核苷酸的差别,相较于1K至数K碱基的完整mRNA序列,检测方法必须要具备足够的灵敏度。因此,用于关键批次放行检测的方法一般会需要设计特异性探针,采用酶切获得5’端寡核苷酸片段,然后通过高分辨LC-MS对不同大小的片段进行分离与相对定量分析,从而得出mRNA的加帽率。
但是传统磁珠法在时间与成本上并不具备优势,兼具低成本、耗时少、高灵敏特点的检测方法成为企业的诉求。因此,近岸蛋白创新研发了mRNA加帽率快速检测试剂盒(专利号:ZL 202311212061 X,目录号:CD002),无需生物素化探针,用专有的沉淀液替代磁珠,可以帮助企业高效率、低成本地完成样品加帽率检测。整个流程仅需1.5小时,回收率大于80%。
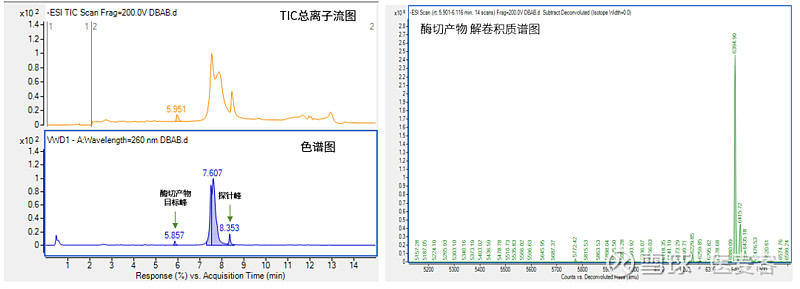
▲图例:UV色谱图与TIC总离子流图显示,本试剂盒处理纯化后的样品在目标峰附近无杂质、无干扰,酶切产物信号值强,解卷积分别可得Cap1及Cap0占比。
针对具体的挑战,提供切实的解决方案,这或许就是一家供应链企业能够为客户、为产业发展做出的最有效贡献。诸如此类的创新产品还有很多,比如mRNA体外转录会产生一种副产物--双链 RNA(dsRNA),也是一项主要的产品相关杂质,会触发人体细胞免疫反应,因此必须严格把控dsRNA在mRNA制剂中的含量。对此,近岸蛋白为客户提供了一套“组合拳”方案。
首先,在上游合成过程中,通过使用T7 RNA聚合突变体(专利号:ZL 2021 1 0044261.3,目录号:GMP-E122)来大幅减少dsRNA的产生量。根据实验数据,经过上百个模板的验证,使用T7 RNA聚合突变体进行IVT能够使dsRNA产物在大多数模板上低于0.1ng/μg,在修饰核苷模板上更是可以低于0.01ng/μg。相较于常规的T7 RNA聚合酶,可谓是在“源头”上数量级降低了dsRNA含量。
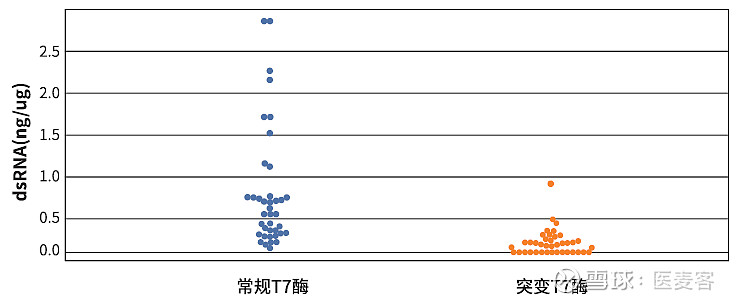
▲图例:突变T7酶大幅降低dsRNA含量
其次,针对dsRNA的含量检测,传统ELISA方法需要分多步反应及清洗步骤,整个实验操作过程需要3个多小时,费时费力。近岸蛋白重点瞄准了这一用户痛点,成功开发出一步法检测dsRNA含量试剂盒--NovoFast dsRNA ELISA Kit(目录号:RD017),使得整个检测过程仅需1.5小时,并且检测灵敏度达到0.047ng/ml。
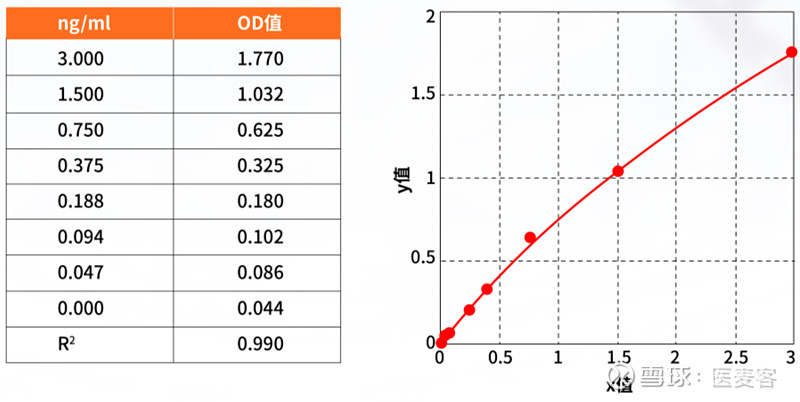
▲图例:NovoFast dsRNA ELISA Kit检测灵敏度
正是这一个个从行业需求与痛点出发的解决方案,使得近岸蛋白在mRNA原料供应领域获得了国内外超100家企业的依赖和应用,助力客户将管线更快地推动至临床,甚至上市。根据2021年Frost & Sullivan的测算,近岸蛋白的mRNA原料在国产品牌中市场占有率排名第一,已有两家企业的mRNA疫苗产品获得国内外EUA,近十个客户项目进入临床阶段。
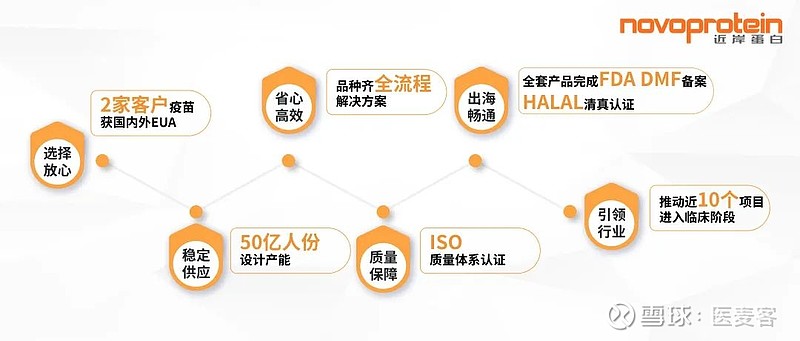
除了为客户解决近忧,企业还需要前瞻性的战略眼光来深谋远虑,才能够为行业发展带来可持续的推动力。比如面对未来可能存在的关键原料海外供应链断层、采购挤兑等问题,近岸蛋白在产能上做出了3至5倍的存量安排,来确保未来10年内原料的稳定、持续输出。与此同时,近岸蛋白也积极将产品进行美国FDA DMF备案,以简化国产mRNA药物出海申报流程。值得一提的是,2022年,近岸蛋白更进一步将mRNA原料生产基地进行了清真认证,这一重要举措无疑将为国内mRNA企业拓展国际市场提供强有力的支持。
管中窥豹,可见一斑。近岸蛋白作为国内mRNA产业链中的一个典型原料供应商代表,通过一系列产品创新与发展布局,我们可以看到的是整个国内mRNA赛道上还有一大批这样的优秀企业正在努力推动这一行业发展。随着全球mRNA巨头Moderna三款mRNA疫苗产品管线的推进,大家对mRNA药物开发的热情也将被进一步点燃。近岸蛋白也将以更加卓越的解决方案,助力国内mRNA企业踏浪前行。
声明及版权说明
声明:本文旨在于传递行业发展信息、探究生物医药前沿进展。文章内容仅代表作者观点,并不代表医麦客立场,亦不构成任何价值判断、投资建议或医疗指导,如有需求请咨询专业人士投资或前往正规医院就诊。
版权说明:本文来自医麦客内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台,转载授权请在文章下方留言获取。

点点“分享”、“点赞”和“在看”,给我充点儿电吧~