
2023年8月7日/医麦客新闻 eMedClub News/--近日,国内邦耀生物利用具有自主知识产权的TyUCell®平台开发的“靶向CD19基因修饰的异体嵌合抗原受体T细胞注射液”BRL-301产品的IND申请在2023年7月27日获CDE临床默示许可,成为国内最快的基因编辑的UCAR-T产品管线之一。
由于目前上市的9款CAR-T产品(FDA批准6款,NMPA批准3款)均为自体CAR-T疗法,导致CAR-T在靶点和适应症上逐渐拥挤碰撞,自体CAR-T不得不在细节和工艺上做优化和比拼。因此改变药物可及性的通用型CAR-T(以下称“UCAR-T”)逐渐成为群雄逐鹿的焦点。
群雄并起,UCAR-T优势与挑战何在?
eMedClub
与众多自体CAR-T不同的是。UCAR-T无需漫长的制备等待时间,可避免相关治疗风险。同时UCAR-T来源自健康供者,T细胞活性强,可有效避免肿瘤污染。此外,UCAR-T的工业化生产过程可有效降低成本和治疗费用,降低患者医疗负担,增加可及性。
但和CAR-T疗法的发展历程相同,安全性问题同样也影响着同种异体CAR-T疗法的发展。例如2020年7月,Cellectis的同种异体CAR-T候选产品UCARTCS1A进行的针对复发性/难治性多发性骨髓瘤(MM)患者的临床试验MELANI-01就因一例患者死于治疗相关的心脏骤停被FDA喊停。这个消息一经发出就成为了热门话题,也为整个行业敲响了警钟。
同种异体CAR-T目前面临的主要问题有:一方面,输入患者体内的异体移植T细胞上的T细胞受体能够识别患者体内的同型抗原并对其进行攻击,从而引发移植物抗宿主病(GVHD);另一方面,患者自身的免疫细胞会识别异体移植CAR-T细胞表面的组织相容性白细胞抗原(HLA),从而攻击输入体内的CAR-T细胞,导致免疫排斥反应。
不同公司制备通用型CAR-T的技术路径不同,但最终目的相同。下面,我们选取全球部分靶向CD19的UCAR-T案例,来说明一下通用型CAR-T是如何实现的。
1.避免免疫排斥:
使用脐带血(UCB)衍生的CAR-T细胞移植可降低GVHD的发生率和严重程度。脐带血中的胚胎干细胞和多功能干细胞的分化程度都比较低,减少自身免疫的出现情况。
除此之外,现阶段UCAR-T创新药企业多使用基于CRISPR/cas9技术的基因编辑平台,现已经探索出了多种不同的应对方法,较为常见的方式敲除HLA基因和TRAC基因等。
当CAR-T细胞来自于HLA不匹配的健康供体时,极大概率会引起严重的血液学毒性,敲除HLA基因或选择HLA匹配的供体能够有效规避此类副作用。而TRAC基因的敲除则意味着TCR同时被清除,由于CAR-T细胞导入了能够识别肿瘤抗原CD19的抗体识别区,敲除以上相关基因后,CAR-T细胞就只识携带CD19分子的B细胞(包括肿瘤细胞),而对其他正常细胞不攻击。就像是制定好了明确指向的作战计划,只攻击同一类目标。
敲除这两个基因外,往往还会伴随着其他位点的敲除或改造,CRISPR-Cas9技术还可以通过敲除编码信号分子的基因如PD1和CTLA4或编码T细胞抑制性受体的基因,增强免疫细胞的活性和持久性。宾大曾在慢病毒递送CD19 CAR的基础上,使用CRISPR–Cas9同时靶向T细胞上的内源性TCR、β 2 -微球蛋白 (β 2 m) 和 PD1 基因,生成了低免疫原性的同种异体CAR-T 细胞。
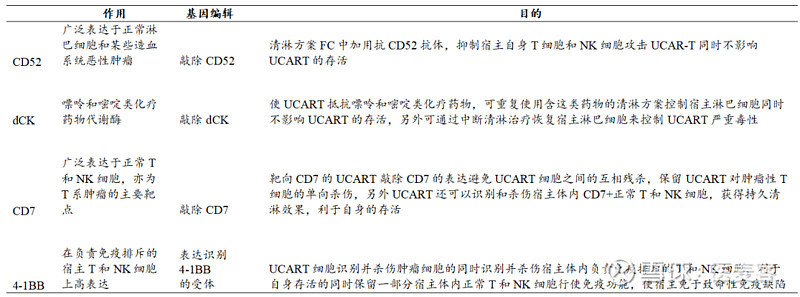
降低宿主免疫反应的基因编辑
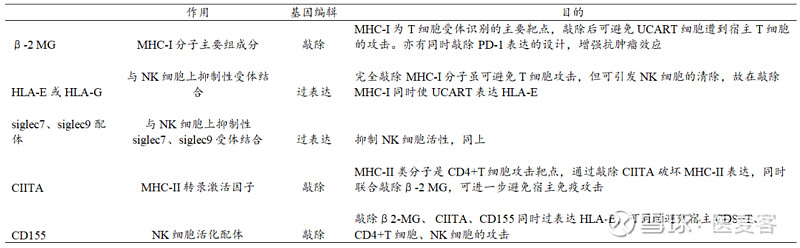
减弱UCART细胞免疫原性的基因编辑
国内较早入局基因编辑的邦耀生物,早前已完成基因编辑造血干细胞疗法BRL-101在地中海贫血领域的布局,并将CRISPR-Cas9技术延伸到细胞治疗领域,UCAR-T产品BRL-301正是通过系统的基因编辑和改造实现有效的免疫逃逸,对B-ALL有较高的CR率,使得达到CR尤其是MRD阴性的患者,在后续桥接异体造血干细胞移植,将能实现更长时间的持续缓解,给患者带来更高的获益。
2.清除淋巴与增强清淋方案:
早期UCAR-T疗效打折很大一部分原因是机体对供体T细胞的清除,因此清淋治疗在UCAR-T治疗中尤为重要。Precision的PBCAR0191在既往Ⅰ/Ⅱa期临床试验中,每次输注UCAR-T均需要进行清淋,以确保异体来源细胞移植效率。
为了增强效果,Precision、CRISPR还在临床中使用增强清淋方案,更高剂量的氟达拉滨和环磷酰胺,Allogene也在清淋方案中加入自研的CD52靶向单抗Allo-674。
高强度的淋巴细胞耗竭可能给患者带来额外的感染风险,T细胞和NK细胞的持续缺乏甚至会增加类似CRS等不良反应威胁生命,无疑又提高了对于患者健康状态的要求。因而最理想的免疫抑制策略是保留部分免疫保护,目前临床更倾向于BRL-301等无需对患者进行额外的清淋或者免疫抑制的UCAR-T产品,以较低的清淋标准换取患者的生存益处,同时较低的清淋方案也意味着产品具有更高的临床安全性和有效性。
3、T细胞选择:
在自体CAR-T的研究中,大量文献证明记忆性T细胞的数目影响着患者的复发时间。晚期肿瘤患者大多经历多线治疗,体内免疫系统功能低下,自体CAR-T生产最需要的是速度和质量,很难再去摸索特定的T细胞亚群配比来提高疗效。而UCAR-T在这方面具有时间优势,在前期扩增时便可以选定特定比例的TN、TSCM、TN、TEMRA等,通过不断的摸索培养条件,以扩增出具有最佳配比的UCAR-T回输制品。
T细胞来源也相当关键,与自体CAR-T不同,邦耀生物等UCAR-T候选产品使用来自健康供体来源的细胞材料,安全性包括GvHD、CRS及NT现阶段大多与自体CAR-T难分伯仲。
UCAR-T的未来
eMedClub
能够大大缩短制备周期,更具成本效益的UCAR-T细胞疗法顺应发展趋势,在肿瘤免疫治疗中与自体CAR-T形成互补的新格局。自体CAR-T目前已在市场具有一定的先发优势,证明了其血液瘤治疗中的有效性;而通用CAR-T的制备可能简化工程细胞的制造过程,更适用于标准化和规模化生产,大大降低当前自体CAR-T疗法的制造成本,减轻患者的治疗负担。
但同时基因编辑技术的发展不可忽视,尤其是UCAR-T关键的GVHD和HvG仍未在临床中得到完美印证,如何平衡疗效和可及性仍是UCAR-T突破的关键因素。
我们也能看到,目前基因编辑技术已成功用于编程T细胞,在体外实现了对T细胞上的TCR与HLA等造成免疫排斥的蛋白的高效敲除,且在不断地完善中,这也是为什么通用CAR-T玩家主要集中在拥有核心基因编辑技术的企业的原因之一。
对于邦耀生物,BRL-301是新的起点也是执着于基因编辑的一个里程碑,在此基础上,基因编辑治疗β-地中海贫血症、非病毒PD1定点整合CAR-T、以及UCAR-T等项目均在临床上取得了优异的成绩。
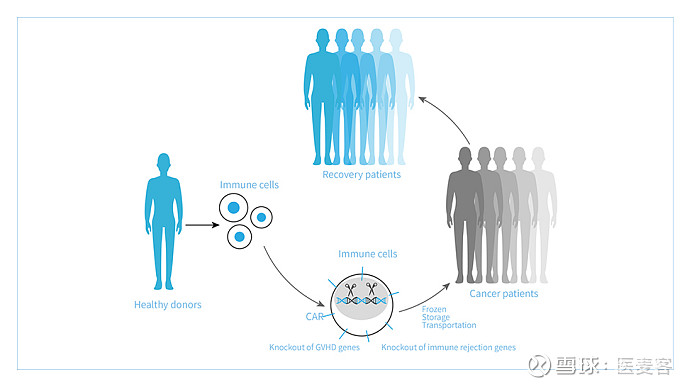
通用型细胞平台TyUCell®(图片来源:邦耀生物官网)
目前,邦耀生物已产生100多项专利成果,有5个项目在8所知名医院开展研究者发起的临床试验,3个项目已获批IND,正式进入注册临床试验阶段,还有多个项目进入IND申报阶段。
小结
eMedClub
随着技术的革新和国内基因编辑龙头企业管线的推进,中国已经走在CAR-T临床研究的前沿,越来越多的CAR-T细胞产品进入疗法开发的研究新药阶段。
然而,在靶点优化、精确调节、功能增强、合成生物学和UCAR-T细胞疗法设计方面仍然存在挑战。通过基因编辑技术和合成生物学的精确调控,国内正在开发更高效的UCAR-T细胞疗法,并取得诸多进展。未来,邦耀生物等创新药企在CAR-T细胞疗法的创新有望提升中国细胞免疫疗法的临床应用价值。
声明及版权说明
声明:本文旨在于传递行业发展信息、探究生物医药前沿进展。文章内容仅代表作者观点,并不代表医麦客立场,亦不构成任何价值判断、投资建议或医疗指导,如有需求请咨询专业人士投资或前往正规医院就诊。
版权说明:本文来自医麦客内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台,转载授权请在文章下方留言获取。

点点“分享”、“点赞”和“在看”,给我充点儿电吧~