
2023年6月4日/医麦客新闻 eMedClub News/--近日,PepGen宣布收到美国食品和药物管理局(FDA)关于其研究性新药申请(IND)的临床搁置通知,以启动PGN-EDODM1在强直性肌营养不良症1型(DM1)患者中的1期研究。FDA表示打算在30内向PepGen提供临床搁置的原因。此前不久,PepGen用于治疗杜氏肌营养不良症(DMD)的PGN-EDO51已经在加拿大通过临床批准开始了2期试验。
PGN-EDODM1利用PepGen专有的增强型递送寡核苷酸(EDO)平台,由细胞穿透肽与空间阻断寡核苷酸偶联而成。旨在将寡核苷酸与DM1患者DMPK转录本中的CUG重复扩张发夹环结合,从而随后纠正导致肌强直和心功能障碍的下游转录本错误剪接事件,在先前发布的临床前数据中表明:
➤未观察到脱靶效应
➤纠正了重复序列的细胞中的错误剪接,并且不会介导DMPK转录本的降解
➤在急性GLP毒理学研究中观察到PGN-EDODM1在非人灵长类中耐受性良好。
➤对肾脏、肝脏或心血管功能没有不良影响。
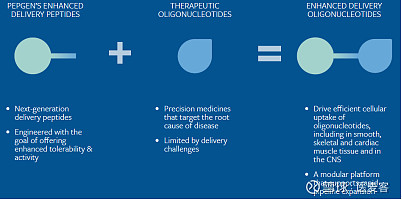
▲ 图片来源:PepGen
目前小核酸疗法常应用于罕见病治疗领域,在肌肉疾病如DMD、DM1和FSHD中,像Serepta以及Pfizer等知名外企都已经加入了研发。其实PepGen被FDA搁置IND申请并不是个例,诸如Serepta、Avidity和Dyne等公司,以及非核酸疗法,都在临床申请或临床试验阶段被FDA叫停过,原因大多是数据不够支持其进入临床或上市,以及出现了严重不良反应事件。
开荒元老Serepta:
从FDA评审纠纷看第一款DMD核酸药物上市
eMedClub
2016年9月19日,Serepta的eteplirsen在争议中上市,也是FDA批准的第一款DMD的核酸药物。eteplirsen自2015年6月26日完成NDA申请,此后一年便在延期、补交数据、委员会争议中度过。FDA批准eteplirsen上市时,发布了一篇长达126页的评审纠纷报告,总结回顾了这一年的经历。
把握行业趋势,点击图片报名
Eteplirsen上市后饱含争议的话题在于,用了替代终点来加速通过上市批准。报告中指出,Serepta将肌肉中的dystrophin蛋白含量(维持肌肉细胞稳定性,DMD患者缺少这种蛋白)作为一个终点,替代了DMD治疗的主要终点,其中包括NSAA、6分钟步行等行动指标。
并且eteplirsen的试验设计有严重缺陷。在201/202试验中仅有12名患者,临床研究样本不足,且FDA测出的dystrophin蛋白含量与Serepta先前数据是不一致的。尽管补充提交了301试验的数据,dystrophin蛋白含量也仅提高了0.3%。
FDA一直强调这是一个特例,也不会降低未来评审的标准。但这次审评受到一些病人,组织和政治人的影响。评审过程还创造了FDA历史上很多的第一次,比如第一次推翻评审专家组意见、第一次要FDA局长出面仲裁等等。eteplirsen在没有明确治疗效果的情况下就批准上市,也可能会阻碍后续研发DMD药物的进展,使FDA对DMD药物的审查更为严格。
不久前Serepta的DMD基因疗法药物SPR-9001,BLA申请被FDA从5月延期到了6月。此前FDA委员会以8比6的投票赞成SPR-9001的加速批准。但会议上有成员提出,2期试验没有能达到NSAA治疗指标。Serepta仿佛回到了2016年,就像当年的eteplirsen,如果通过了审批,SPR-9001将成为第一款DMD基因疗法药物。

▲ 图片来源:Sarepta
后起之秀Dyne:进展神速,
实现肌肉/CNS双重递送
eMedClub
Dyne therapeutics与PepGen同样在2018年成立,但其发展却是突飞猛进。Dyne和Avidity主打利用抗体偶联寡核苷酸技术(AOC)递送小核酸进入肌肉组织中。其用于治疗DM1的DYNE-101一路开了绿灯,在ASGCT2022/2023上都展示了其对DMPK病灶强大的清除程度,并且在中枢神经系统(CNS)中也展示出了药理作用,表现出对伴有CNS症状的DM1患者的治疗潜力。在ASGCT2022/2023后,分别获得了FDA的IND批准和EMA孤儿药认定。
与DYNE-101相比,用于DMD的DYNE-251则没这么顺利。和PGN-EDODM1一样,在2022年1月,IND阶段就被FDA搁置了,6个月后才通过审批。FDA当时给出的答复是,需要提供DYNE-251的更多临床和临床前信息,PepGen有可能也会收到类似的答复。之后,DYNE-251和DYNE-101临床进展持平(1/2期),并且先后在Nucleic Acids Research发刊、获得了FDA快速通道、孤儿药和罕见病药物的认定。

▲ 图片来源:Dyne
初尝胜果Avidity:从“鬼门关”走了一遭
eMedClub
Avidity Biosciences的AOC-1001项目于2021年开始了1期临床试验。但去年9月FDA审查了该项目的严重不良事件报告后,决定对该项目进行部分临床搁置,原因是有一名患者出现了及其罕见的神经系统疾病,包括丘脑外侧膝状核区域的双侧缺血以及随后的出血性转化,并且Avidity无法确定AOC-1001和其中的关系。
在今年4月的美国精神病学会年会上(AAN),Avidity展示了该项目的积极数据,证明了多种临床结局指标、疾病改变以及良好的安全性和耐受性特征的功能改善。于是5月17日,Avidity宣布FDA放宽了临床搁置,允许增加给药剂量和更多的受试者招募,以支持AOC-1001进入3期临床试验。
在5月24日,Avidity Biosciences的科研人员在Nucleic Acids Research上发表了文章“Targeted tissue delivery of RNA therapeutics using antibody–oligonucleotide conjugates(AOCs)”。文中进一步验证了其AOC平台在临床前阶段实现了组织的特异靶向性,在体内具有良好的药理活性,以及AOC平台适用于siRNA、ASO和PMO。

▲ 图片来源:Avidity
结语
eMedClub
PepGen的IND申请被FDA搁置,是很多DMD核酸药物研发过程中的一个缩影。从eteplirsen饱受争议的上市开始,在IND、临床试验、上市等阶段,可以看出FDA对DMD药物的评审标准开始变得严格。但核酸疗法也表现出了在罕见肌肉疾病的治疗潜力,也诞生了许多新的靶向递送技术,加速核酸药物多治疗领域的发展。
参考资料:
1.网页链接
2.网页链接
声明及版权说明
声明:本文旨在于传递行业发展信息、探究生物医药前沿进展。文章内容仅代表作者观点,并不代表医麦客立场,亦不构成任何价值判断、投资建议或医疗指导,如有需求请咨询专业人士投资或前往正规医院就诊。
版权说明:本文来自医麦客内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台,转载授权请在文章下方留言获取。

点点“分享”、“点赞”和“在看”,给我充点儿电吧~