2023年5月27日/医麦客新闻 eMedClub News/--在实体瘤中,大多数肿瘤靶抗原是与正常细胞共通的,这种靶向、非肿瘤毒性方面存在的风险,一定程度上阻碍了CAR-T细胞在实体肿瘤治疗中的发展。因此,很多研究人员试图应用布尔逻辑门控(Boolean Logic Gate,含AND,OR,NOT)方法对CAR-T的细胞毒性进行预防性设计。
近期在Nature上,一篇以“CAR-T cell design: approaching the elusive AND-gate”为题的文章中,Tousley等人设计了逻辑门控胞内网络CAR(LINK CAR、图a),该系统使用近端信号分子与膜结合的抗原结合域(如单链可变片段scFvs)融合,通过共同识别两种抗原来实现肿瘤特异性,同时保留了抗肿瘤的功效而不损害其活性,能扩展到实体肿瘤治疗领域。

▲ 图片来源:NATURE
以往CAR-T克服免疫抑制机制的策略包括使用合成的NOTCH(synNotch)受体或其他蛋白开关,synNotch可以在原代T细胞中定制反应程式,驱动分泌指定的细胞因子、扭转T细胞分化、局部递送非天然的治疗药物(抗体等)来应对抗原, 但其缺陷是肿瘤外的毒性可能杀死健康细胞。而另一类蛋白开关的药代动力学和生物分布具有挑战性,需要优化效应细胞和靶细胞的突触,且其中的人工成分可能会诱发免疫原性,存在限制T细胞持久性的风险。而LINK CAR弥补了上述两种方案的缺陷,有望成为一种真正安全、特异和高效的逻辑门控CAR方法。
Tousley等人设计了一种基于ZAP-70的LINK CAR,与基于4-1BB/CD3ζ的第二代CAR相比,它绕过了CD3ζ模块,并保持了相同的体外IL-2产量和细胞毒性。这种新型ZAP-70 CAR设计使用包含天然接头、结构域间B和Zap-70激酶结构域的细胞内结构,排除SH2结构域。关键T细胞近端(PLCγ1和SLP-76)、远端(AKT和ERK)和NFκB信号激活研究表明:ZAP-70KIDB相对于基于CD28和4-1BB的第二代CARs,CAR-T细胞在靶细胞刺激过程中表现出相似的磷酸化水平和更低的碱基水平。这些发现表明,由于较低的强直信号和随后的T细胞耗竭,ZAP -70可能具有更好的治疗效果,这一结论得到了临床前动物模型的支持。
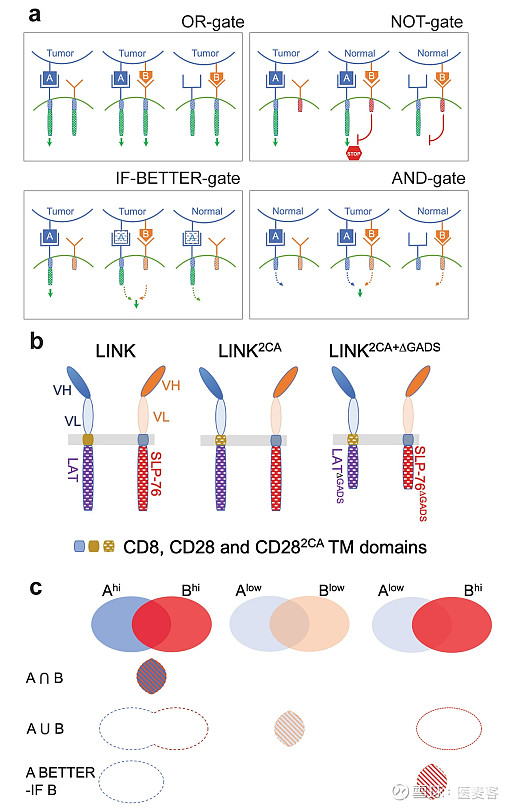
▲ 逻辑门CAR-T细胞的原理(图片来源:NATURE)
在T细胞活化过程中,ZAP-70磷酸化LAT和SLP-76,然后形成下游信号转导的支架。CRISPR-Cas9敲除实验表明,LAT和SLP-76对于CAR-T细胞效应子功能都是必不可少的。研究者创造了一种分裂CAR设计称为“LINK”,它包含两种不同的scFvs,LAT和SLP-76,以产生“与”门CAR-T细胞,把ZAP-70下游的LAT、SLP-76安装在识别不同肿瘤抗原的scFv上,让CAR-T只对同时表达两个抗原的靶细胞产生响应(图b)。

把握行业趋势,点击图片报名
LINK CAR设计包含一条scFv(抗原A)-cd28tm-LAT链和第二条scFv(抗原B)-CD8 TM-SLP-76链,它们被共转导到T细胞中。体外细胞因子产生和细胞毒性实验发现,LINK CAR-T细胞通过对仅表达两种抗原之一的靶细胞作出反应而显示出一定程度的渗漏。为了避免出现泄漏,加强门控控制,做出了进一步改进。这些构建体通过在两个构建体之间交替使用CAR跨膜结构域,突变了LAT链的CD28跨膜结构域中的半胱氨酸残基,产生了连接“2CA”,以防止LAT链二聚化引起的SLP-76链的旁观者激活,减少了单抗原渗漏。由于LAT和SLP-76不直接相互作用,而是通过衔接分子如GADS形成下游信号转导的支架,为了中断该系统中两个不同CAR的相互作用并避免其余的泄漏,Tousley等人敲除了LAT和SLP-76结构域中适应蛋白GADS的结合位点。由于“链接2CA+δGADS”设计控制在体外,几乎能消除全部的单抗原渗漏。复杂的LINK CAR系统几乎只在两种抗原都被LINK CARs结合时才会激活T细胞,特异性靶向细胞溶解能力与基于CD28和4-1BB的CARs能力相似。
ROR1是多种癌症和基质细胞中表达的靶标,ROR1特异性CAR-T细胞可通过识别髓质基质细胞诱导致死性骨髓衰竭。使用CD19和ROR1双阳性NALM6异种移植小鼠模型测试了靶向CD19和ROR1的LINK CAR-T细胞设计,并与其他逻辑门控系统(如SynNotch CAR-T)进行了比较。输注高剂量的LINK CAR-T细胞(每只小鼠800万个CAR-T细胞)显示了特异性和有效的抗肿瘤功效,而SynNotch和SPLIT CAR系统则会引起目标上、肿瘤外的毒性,对动物产生致命后果。此外,在一个B细胞移植实验中,作者证明LINK系统可以保护只表达一种目标抗原的正常组织,在安全性方面有较好的保障。
然而逻辑门CAR-T也有自身的局限性,会使CAR-T细胞的复杂化,从而增加出错的风险。同时,AND逻辑门需要共同识别两种抗原,避免误伤健康细胞的同时也增加了肿瘤免疫逃逸的风险。因为肿瘤只要丢失任何一个靶点,就能逃脱疗法的攻击。因此,控制CAR-T复杂程度,仔细选择目标靶点将是LINK CAR-T细胞系统走入临床的关键步骤。
结语
eMedClub
“与”门理论为新型免疫疗法开辟了道路,扩大了可靶向分子的范围,能够在缺乏真正的肿瘤限制性抗原的情况下实现特异性T细胞靶向。LINK CAR-T细胞在提高特异性和安全性方面具有很大的前景,依靠对恶性和正常细胞上组合表达模式的精确分析,CAR疗法有望扩展到实体瘤患者群体,乃至为自身免疫或衰老相关的疾病患者带来治愈的曙光。
参考资料:
1.网页链接
声明及版权说明
声明:本文旨在于传递行业发展信息、探究生物医药前沿进展。文章内容仅代表作者观点,并不代表医麦客立场,亦不构成任何价值判断、投资建议或医疗指导,如有需求请咨询专业人士投资或前往正规医院就诊。
版权说明:本文来自医麦客内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台,转载授权请在文章下方留言获取。

点点“分享”、“点赞”和“在看”,给我充点儿电吧~