
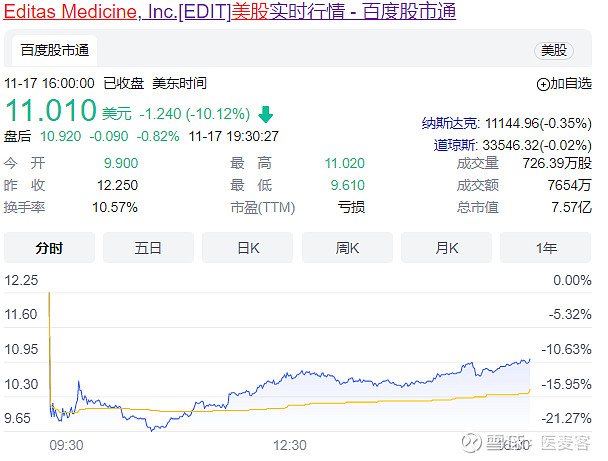
2022年11月19日/医麦客新闻 eMedClub News/--11月17日,临床阶段基因编辑公司Editas Medicine公布了其体内CRISPR/Cas9基因编辑疗法EDIT-101治疗Leber先天性黑矇10(LCA10)的1/2期试验BRILLIANCE的临床数据。同时,该公司宣布将暂停该临床试验,停止招募患者,以寻求合作伙伴继续开发EDIT-101。

而受此消息影响,截止当日收盘,Editas公司的股价下跌10.12%,为11.01美元/股。
SVB Securities分析师Mani Foroohar曾在周四一份报道中表示,尽管Editas计划为EDIT-101寻找开发合作伙伴,但是鉴于有限的商业机会、眼科基因编辑产品的复杂性和开发成本,目前尚不清楚它是否能够轻松找到一个合作伙伴。
这其中究竟发生了什么?为何Editas要做出这样的决策?
Leber先天性黑蒙10型(LCA10)是一种罕见的常染色体隐性遗传病,由CEP290基因中的双等位基因功能丧失突变引起。LCA10通常出现在婴儿早期,患者表现出严重的视锥营养不良,而且视力低下,甚至完全丧失。目前,针对此疾病还尚无有效的治疗方法。
EDIT-101是一款体内CRISPR/Cas9基因编辑疗法,其通过将编码Cas9的基因和两个指导RNA(gRNA)装载进AAV5病毒载体,然后通过视网膜下注射直接注射到患者感光细胞附近,将基因编辑系统递送到感光细胞中。当感光细胞表达基因编辑系统时,gRNA指导的基因编辑可以消除或逆转CEP290基因上致病的IVS26突变,从而改善感光细胞功能,为患者带来临床益处。此前,EDIT-101已获得美国FDA的罕见儿科疾病和孤儿药称号,以及欧洲药品管理局(EMA)的孤儿药称号。
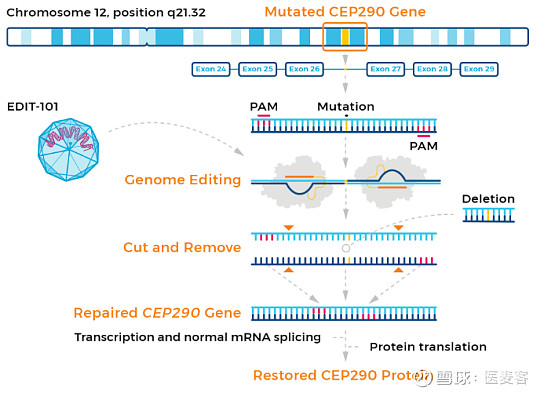 ▲EDIT-101 (图片来源:Editas官网)
▲EDIT-101 (图片来源:Editas官网)
最新1/2期试验BRILLIANCE数据显示:
14名接受治疗的受试者中,有3人达到了缓解阈值,在最佳矫正视力(BCVA)(LogMAR>0.3)方面有临床意义的改善,并在光敏感性(FST),视觉功能导航过程(VFN)或视觉功能生活质量(VFQ)三个附加终点中的两个方面表现出持续的改善。此外,对治疗受益患者基线特征的检查显示,3名受益患者中有2名为IVS26纯合子突变,且未发现其他可以预先选择应答患者群体的基线特征。百吉生物正在招聘高级科学家,薪资面议,点击查看>>>
在安全性方面EDIT-101显示出良好的耐受性,大多数不良事件都是轻微的且未观察到眼部严重不良事件或剂量限制毒性。
根据以上临床数据所显示,受益的3名患者中有2名为IVS26突变纯合的LCA10患者,表明此类突变患者在EDIT-101的治疗中可能受益最多。
值得一提的是,CEP290 IVS26突变纯合的LCA10患者在美国大约仅300人,该公司表示将不会独立进行该项目,或是出于此类患者人群较少,风险大以及对将来商业模式的考虑。Editas目前正在暂停BRILLIANCE试验的招募,并欲寻求找到一个合作伙伴来继续开发EDIT-101,至于未来会针对该候选疗法做出什么调整,尚未可知。但该公司也将继续对迄今为止接受治疗的所有患者进行长期随访。

体内基因编辑方兴未艾
CRISPR基因编辑技术自问世以来不但在基础研究领域,而且在临床开发方面也获得飞速的进展。
实现基因编辑的渠道分为两种,一种是较为成熟的体外基因编辑,目前体外CRISPR已接近上市“大考”,在今年9月27日,Vertex Pharmaceuticals与CRISPR Therapeutics公司宣布将从2022年11月开始向FDA滚动提交其CRISPR细胞治疗候选产品exa-cel(CTX001)的生物制剂许可申请(BLA),并预计将在2023年第一季度末完成提交。

另一种则是体内基因编辑,体内基因编辑则是在患者体内直接改造病变基因,主流策略大多采用LNP装载Cas9 mRNA和CRISPR sgRNA、或利用AAV病毒将CRISPR-Cas9系统递送至目标器官或组织。
相较于体外编辑,体内CRISPR基因编辑具有较高的技术壁垒,产品的临床转化仍具有较高的挑战。其中一大部分原因是缺乏将基因组编辑工具递送到广泛的人体组织和器官中,同时又可以避免免疫原性和遗传毒性等风险的安全有效的方法。
尽管现阶段体内编辑仍面临诸多挑战,但其应用场景相较于比体外更为广泛,包括在眼睛、耳朵、神经系统、肌肉、肝脏、心脏等相关疾病,因此,体内基因编辑疗法也是各大基因编辑公司的 “兵家必争之地”,想象空间更大,未来体内基因编辑疗法或将是基因编辑发展的大趋势。
目前,除了Editas外,Intellia Therapeutics、Sangamo Therapeutics、CRISPR Therapeutics以及国内瑞风生物、新芽基因等一些基因编辑企业在此领域有所布局,并且多款候选产品在临床上展现了良好的安全性与疗效。
诸如NTLA-2001就是Intellia开发体内基因编辑疗法,其旨在通过LNP,将靶向TTR基因的CRISPR基因编辑系统递送到人体内,特异性敲除肝细胞内的TTR基因,从而降低TTR蛋白的表达,以治疗转甲状腺素蛋白(ATTR)淀粉样。在最新公布数据中显示,12名转甲状腺素蛋白淀粉样变性患者进行单次静脉注射给药后28天,所有患者的血清TTR降低≥90%,且安全性良好。
推荐阅读:Intellia 两款体内CRISPR基因编辑疗法最新数据亮眼,具备“功能性治愈”遗传性罕见病潜力
值得一提的是,Sangamo Therapeutics也在进行体内基因编辑,但是Sangamo使用的是锌指蛋白核酸酶(ZFN)技术。

结语
诚然,在人体内进行基因编辑,其递送和安全性等方面仍然存在多重挑战。但这一领域的新科学发现也层出不穷,如现在多家研究机构已发现分子量更小的Cas酶和具有基因编辑能力的新蛋白酶,这将为解决基因编辑系统递送的挑战提供了新工具。
另外就临床数据来说,比起疗效突出,当前市场也十分关安全性数据。尽管此次Editas暂停了试验,但其安全性已可验证。期待随着新技术的不断涌现和基因编辑技术的不断成熟,这一创新治疗模式能够早日发挥出它的全部潜力,为患者带来治愈性疗法。而对于体内基因编辑是否会脱靶,安全性究竟如何,随着越来越多的临床数据提供,时间将会给出答案。
参考资料:
1.网页链接
2.网页链接
——近期热门活动一览——
11月23日,mRNA疫苗质量控制关键要素