医麦客近期热门报道
★邀请函丨2021 CSGCT 基因与细胞治疗医学峰会即将在上海召开
★离体慢病毒基因治疗呈现积极试验结果,力求使患者摆脱慢性治疗的负担丨医麦猛爆料
2021年11月27日/医麦客新闻 eMedClub News/--近日,专注于细胞外蛋白质降解的生物制药公司Avilar Therapeutics宣布获得创始投资者RA Capital Management 6000万美元的种子融资。Avilar正在开发一类新型蛋白质降解剂疗法,旨在靶向致病的细胞外蛋白质,将蛋白质降解的范围扩展到靶向细胞内蛋白质的初始降解剂之外。

靶向蛋白质降解已成为一种强大的新药模式,广泛适用于多种疾病。迄今为止,蛋白质降解工作已成功应用于细胞内蛋白质靶标。Avilar现在正在将蛋白质降解的范围和治疗潜力扩展到广泛的细胞外蛋白质领域。
RA Capital在蛋白质降解领域拥有丰富的经验。迄今为止,RA Capital已经投资过Arvinas、C4 Therapeutics、Frontier Medicines和Vividion等细胞内降解公司。现在推出Avilar,希望超越细胞内降解并在细胞外蛋白质降解领域建立领先地位。
Avilar Therapeutics的首席执行官兼总裁Daniel Grau表示:“我们相信细胞外蛋白质的世界代表了蛋白质降解的下一个前沿领域,我们很高兴将Avilar作为这个新领域的先驱公司推出。”
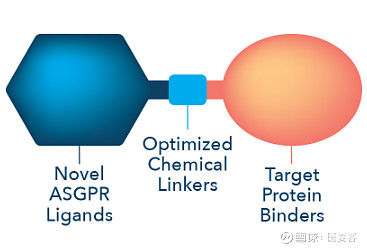
▲ 图片来源:Avilar Therapeutics官网
Avilar建立的专有技术平台名为ATACs(ASGPR Targeting Chemeras),即去唾液酸糖蛋白受体靶向嵌合体。ASGPR是一种内吞细胞表面受体,在内源性蛋白质被内化到肝细胞中被降解的自然过程中起关键作用。ATACs旨在利用这种自然的 ASGPR降解途径。ATACs是双功能分子,包含与ASGPR结合的配体,和与致病细胞外蛋白结合的第二配体偶联。ATACs的工作原理是与致病蛋白质结合并将其从循环中穿梭到肝细胞内溶酶体,其中不需要的蛋白质被降解。

▲ 图片来源:Avilar Therapeutics官网
Avilar药物发现平台的关键组件包括新型ASGPR化学成分、模块化组装、细胞外降解建模和蛋白质组图谱。
▲ 新型ASGPR化学物质
新型ASGPR化学物质使用X射线结构引导方法,Avilar发现了一个小分子、高亲和力ASGPR配体库,与传统的ASGPR结合剂相比,该配体具有单价功能和优越的性能。
▲ 模块化组装
优化的小分子ASGPR配体是模块化的,可以有效地整合到具有不同蛋白质结合剂的ATACs中,以靶向各种引起疾病的细胞外蛋白质。
▲ 细胞外降解建模
Avilar开发了专门的数学建模工具来整合和预测ATACs介导的内吞作用和降解的独特生物物理、药代动力学和药效学特征。
▲ 蛋白质组图谱
蛋白质组图谱是Avilar的蛋白质信息学系统,可对细胞外蛋白质信息进行广泛编目,并为管线目标选择、蛋白质结合剂设计和ATACs开发提供高级见解。
Avilar通过靶向细胞外蛋白质开创了蛋白质降解的下一个前沿领域。Daniel Grau 表示:“Avilar已经在啮齿动物和非人类灵长类动物研究中证明了ATACs介导的蛋白质降解的体内概念验证,我们期待着将ATACs作为一种新型药物来推进,以降解参与各种人类疾病发病机制的蛋白质。”
Avilar Therapeutics创始投资者,RA Capital投资过的蛋白降解技术公司:
➤ Arvinas
Arvinas是靶向蛋白质降解技术的先驱。目前正在设计一个针对嵌合体或PROTAC蛋白质降解剂的蛋白质水解的广泛管线,旨在利用人体自身的天然蛋白质处理系统(泛素蛋白酶体系统)选择性地有效地降解和去除致病蛋白质。
Arvinas正在开发ARV-110,这是一种靶向雄激素受体(AR)的PROTAC蛋白降解剂,用于治疗转移性去势抵抗性前列腺癌(mCRPC)患者的潜在治疗,该计划目前处于2期临床研究阶段。
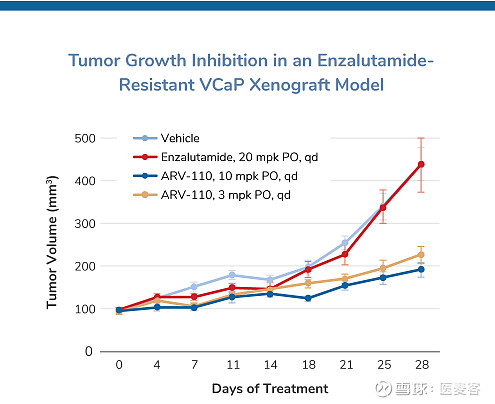
▲ 图片来源:Arvinas官网
在临床前研究中,ARV-110作为AR的靶向降解剂显示出有希望的活性。在恩杂鲁胺敏感模型中,ARV-110显示出与恩杂鲁胺相似的前列腺特异性抗原(PSA)减少,但剂量较低。在获得性和对恩杂鲁胺的内在抗性的体内模型中,ARV-110已被证明分别抑制肿瘤生长70%和100%。
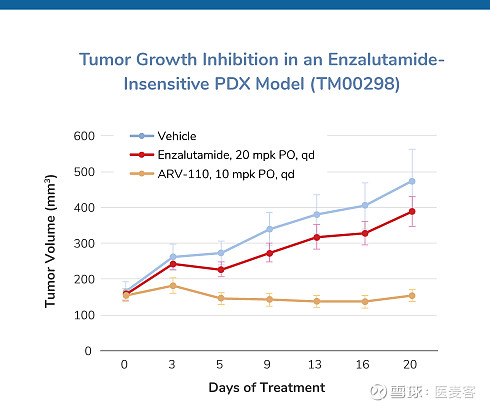
▲ 图片来源:Arvinas官网
在来自未接受恩杂鲁胺治疗但对恩杂鲁胺不敏感的患者的患者衍生的异种移植物(PDX)模型中,口服递送的ARV-110显著抑制了恩杂鲁胺不敏感肿瘤的生长(肿瘤生长抑制:100%)。
➤ Vividion
Vividion Therapeutics正在消除可药物治疗的界限,为多个治疗领域具有关键未满足需求的患者开发治疗方法。
2020年5月19日,Vividion Therapeutics宣布与罗氏(Roche)签订了一项全球独家许可协议。在这一协议中,Vividion将利用其独有的蛋白质组学筛选平台和小分子库来开发靶向新型E3泛素连接酶的配体。这些全新的E3配体将用于为一系列传统上难以成药的肿瘤学和免疫学靶标开发靶向蛋白降解药物。
▲Vividion专有的蛋白质组学筛选平台(图片来源:Vividion官网)
Vividion的方法使其能够在多种模式下使药物开发工作多样化,包括变构激活剂和抑制剂、蛋白质稳定剂、抑制剂和蛋白质降解剂。
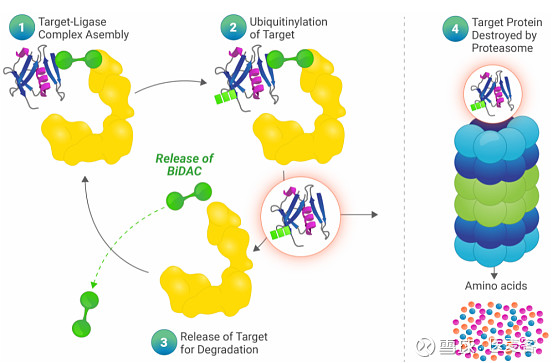
▲靶向蛋白质降解是如何工作的(图片来源:C4 Therapeutics官网)
C4T开创了一种新的定量方法来发现降解分子,这些分子可以靶向导致严重疾病的蛋白质。C4的TORPEDO平台(Target或定向ProtEin Degrader Optimizer)合成了一类新的小分子药物,旨在选择性和有效地破坏致病蛋白,包括以前被认为是不可药用的靶标。
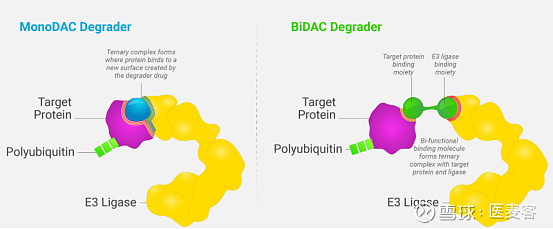
▲图片来源:C4 Therapeutics官网
C4正在推进MonoDACs和BiDACs两种类型的蛋白质降解剂,每种降解物都旨在产生相同的终点-目标蛋白质的特定降解。MonoDACs是单功能降解激活化合物,其通过与E3连接酶结合并在E3连接酶上产生新表面来增强E3连接酶与靶蛋白的结合而起作用。MonoDAC有时被称为"分子胶"。BiDACs是双功能降解激活化合物,其设计使得分子的一端与致病靶蛋白结合,另一端与E3连接酶结合。BiDAC有时被称为"异双功能降解剂"。
➤ Frontier Medicines
Frontier成立于2018年,是PROTAC领域内相对而言的“后来者”。Frontier正在开发针对重要致病蛋白质的精准药物,生物制药行业无法通过标准药物干预进行药物治疗。Frontier的药物发现平台利用化学蛋白质组学,共价药物发现和机器学习方面的突破性科学方法来发现和药理学靶向无序区域内的口袋和这些蛋白质上的神秘结合位点,使它们可以通过小分子药物进行治疗干预。
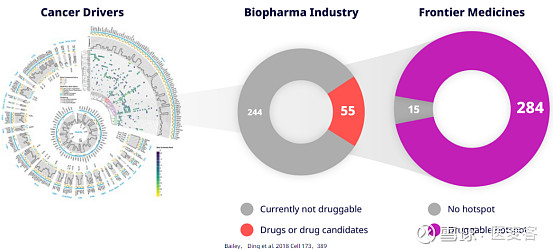
▲ 图片来源:Frontier 官网
2020年12月2日,艾伯维(AbbVie)宣布与 Frontier Medicines 达成全球战略合作。通过这项合作,艾伯维和Frontier将利用Frontier专有的化学蛋白质组学平台研发针对肿瘤学和免疫学疾病的、基于E3泛素连接酶的蛋白降解药物。E3泛素连接酶也是蛋白降解领域内诸如Arvinas和Kymera Therapeutics等领先企业的研究核心所在。
针对“不可成药”靶点,Frontier Medicines认为:当蛋白质移动时,它们会弯曲并形成可与药物结合的临时区域。利用化学蛋白质组学技术,Frontier发现大多数人类蛋白质都具有这些临时区域,以及如何使用新药选择性地靶向这些以往“不可成药”的蛋白质,从而实现新药研发和疾病治疗的范式转换。
参考资料:
1.网页链接
2.网页链接
3.凡默谷《靶向蛋白质降解的新兴技术及其研究进展》
4.网页链接
5.网页链接
6.网页链接
7.网页链接
8.Cullgen《【新闻】Vividion宣布与罗氏开展靶向蛋白降解药物发现的合作》
9.生辉《5500万美元预付款,艾伯维联手Frontier开发靶向“不可成药”靶点的蛋白降解剂》
