
本文由医麦客原创,欢迎分享,转载须授权
2020年6月1日/医麦客新闻 eMedClub News/--受新冠疫情影响,一年一度的全球肿瘤界盛会-美国临床肿瘤学会(ASCO)年会于今年5月29日〜6月2日首次以线上形式召开。
本月中旬,致力于通用型CAR-T细胞开发的Allogene Therapeutics在此次ASCO年会上提交了其通用CAR-T疗法ALLO-501(靶向CD19)在复发/难治性大B细胞淋巴瘤或滤泡性淋巴瘤(R/R LBCL/FL)中进行的Ⅰ期剂量递增研究(ALPHA)的首批数据作为摘要。但该数据仅包括逐步增加剂量的ALLO-501和较低剂量(39mg)ALLO-647治疗的前9名患者的初步数据。
推荐阅读:ASCO:通用CD19 CAR-T展现极具竞争优势的安全性和缓解率丨医麦猛爆料
5月29日,ASCO会议如期召开,Allogene在会上公布了ALLO-501三线及以上治疗复发难治性非霍奇金淋巴瘤(NHL)的Ⅰ期临床研究(ALPHA)取得的积极数据。这一数据包括迄今为止(截至2020年5月)接受治疗的所有22名患者的详细情况。
▲ 图片来源:Allogene官网
这项结果的公布引起了华尔街分析师的广泛关注。Jefferies的Amin估计,到2030年,ALLO-501预计能达到8.42亿美元的销售峰值。自今年5月中旬Allogene首次公布试验的初步结果以来,该公司的股价已经上涨了近60%。

包括22名患者的最新数据
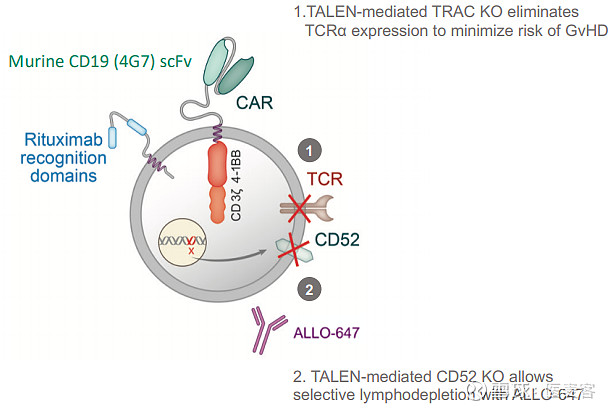
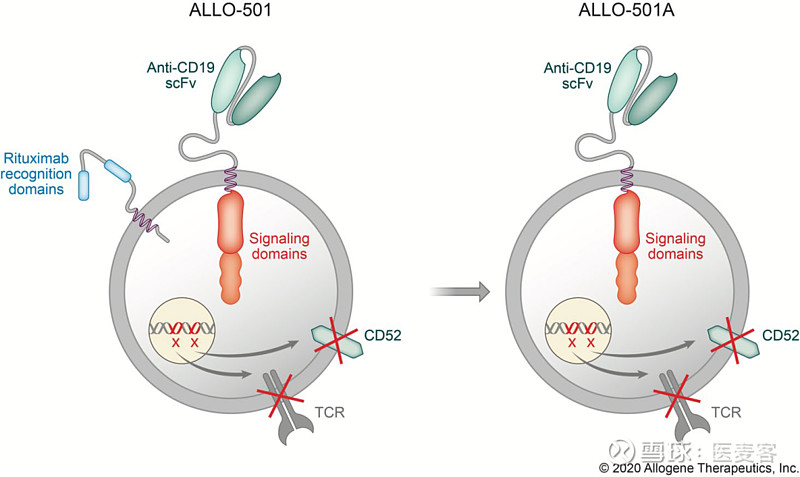
ALLO-501是一种基因修饰的抗CD19 CAR-T细胞产品,其中的TCRα恒定基因被破坏,以减少移植物抗宿主病(GvHD)的风险,而其CD52基因被破坏以允许使用CD52单抗ALLO-647 ,用于选择性和延长宿主的淋巴细胞清除。这项研究(ALPHA)就利用了Allogene的抗CD52单克隆抗体(mAb)ALLO-647作为其差异化淋巴清除方案的一部分。
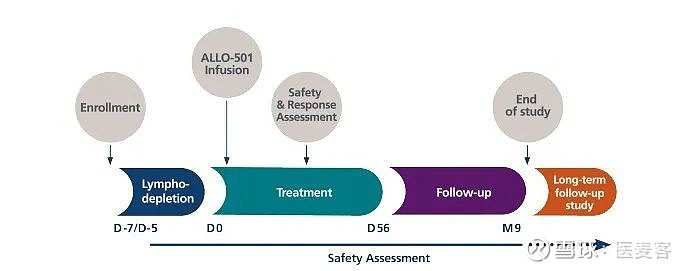
截至2020年5月的数据,有23例患者入组,22例患者接受了ALLO-501治疗。一名患者由于尿路阻塞引起的急性肾功能衰竭而在淋巴结清扫前从研究中移除。从入组到开始治疗的中位时间为5天。
ALPHA的临床设计包括3种ALLO-501剂量,以及2种剂量CD52单抗ALLO-647(39mg、90mg)进行淋巴清除。

▲ 图片来源:Allogene官网
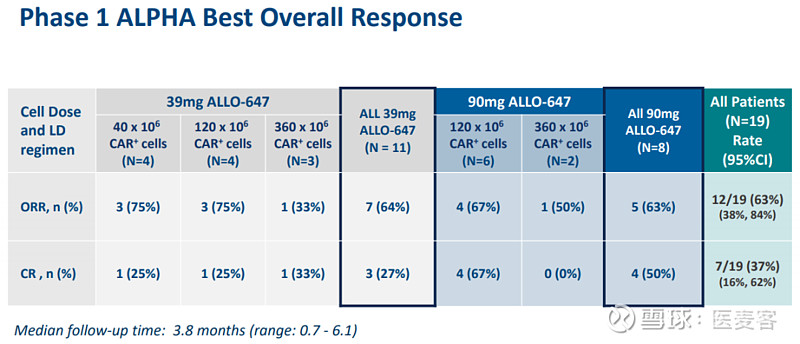
在有效性方面,22名患者中有19名接受了至少一个月的评估。在所有细胞剂量和肿瘤组织学(弥漫性大B细胞淋巴瘤和滤泡性淋巴瘤)中观察到反应,总缓解率(ORR)为63%,完全反应(CR)率为37%。较高剂量的ALLO-647与较高的CR(50%)率、更深的淋巴清除以及宿主T细胞恢复延迟有关。
▲ 图片来源:Allogene官网

▲ 经治疗的各患者中观察到的肿瘤缩小情况
(图片来源:Allogene官网)
其中位随访时间为3.8个月,到数据截止时间,12例有反应的患者中有9例(75%)持续缓解。

▲ 图片来源:Allogene官网
值得注意的是,在持续缓解的患者中,有1例患者的情况是,最初产生了部分缓解(PR),但在第2个月的时候复发,在用相同剂量的ALLO-501和更高剂量(90mg)的ALLO-647再次治疗后获得了CR。该患者在这一研究中记录为PR,而不是CR。
此外,总体疗效分析中还包括3例先前使用自体CAR-T治疗无效的患者。这些患者对AlloCAR-T治疗也无效。因此,在初次接受CAR-T治疗的患者中,ORR为75%,CR率为44%。

▲ 图片来源:参考出处2
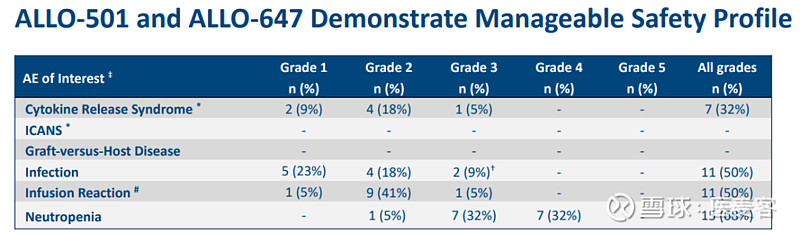
安全性方面,在ALLO-501和ALLO-647的所有剂量水平上均观察到不良事件。在ALLO-501细胞剂量水平为 40 x 106和120 x 106 以及在ALLO-647两种剂量水平下均观察到严重的不良事件(SAE)。未观察到剂量限制毒性、移植物抗宿主病或免疫效应细胞相关神经毒性综合征(ICANS)。
细胞因子释放综合征(CRS)发生在32%的患者中,严重程度主要为轻度至中度,可以通过标准方案进行处理,所有事件最多可以在7天内解决。与用39mg ALLO-647治疗的患者相比,用90mg ALLO-647治疗的患者的感染没有增加。
4名患者(18%)经历了SAE。1名患者发生了2级发热和2级巨细胞病毒(CMV)激活,分别在2天和6天内恢复;1名患者发生3级轮状病毒感染和3级低血钾症,分别在15天和2天后消失;1名患者发生3级发热性中性粒细胞减少和3级低血压,均在2天内消退;1例患者的3级上消化道出血在1天之内解决,而3级CMV再激活则在25天内解决。
▲ 图片来源:Allogene官网
Allogene总裁、首席执行官兼联合创始人David Chang博士说:“我们对第一阶段的最初结果感到非常满意,这表明ALLO-501和ALLO-647在晚期NHL患者中具有良好的耐受性并产生了完全缓解。基于这些结果,我们相信我们在正确的道路上使AlloCAR-T治疗对患者成为现实。”

▲David Chang
Allogene还在开发ALLO-501的下一代产品ALLO-501A,它消除了利妥昔单抗(rituximab)识别域,以拓展应用范围至接受过利妥昔单抗治疗的NHL患者,并打算用于Ⅱ期开发。Allogene计划在2020年第二季度开始ALPHA2的研究,目前,ALLO-501A的ALPHA2试验的第一阶段部分已经开始注册。
▲ 图片来源:Allogene官网

极具竞争潜力
Allogene Therapeutics在2018年4月由Kite的创始人、首席执行官 Arie Belldegrun 携手原 Kite 研发执行副总裁兼首席医学官 David Chang 博士创立,致力于打造同种异体的“通用型”CAR-T疗法。
在Allogene公司成立之初,便同时与辉瑞(Pfizer)、Cellectis以及Servier多家知名生物医药公司达成合作,接手推进辉瑞的CAR-T和UCART产品线,包括此前授权自Cellectis和Servier的16个临床前CAR-T项目以及授权自Servier的UCART-19项目。
目前上市的CAR-T疗法仅两款,一款是诺华(Novartis)的Kymriah。Kymriah定价47.5万美元,另一款是吉利德/Kite的Yescarta,定价37.3万美元,它们也都靶向CD19,但都属于自体CAR-T策略。
Kymriah目前获批用于复发/难治性弥漫性大B细胞淋巴瘤(DLBCL)的成年患者以及急性淋巴细胞性白血病(ALL)的儿童和青年;Yescarta获批用于用于复发性或难治性大B细胞淋巴瘤(LBCL)成人患者。
可见,在适应症上,ALLO-501与市场上的2款CAR-T有重合之处。
从目前的数据来看,同种异体的通用型ALLO-501表现出理想的安全性和有效性。由于其具有大幅度缩短治疗时间,可批量生产,无需个体化定制等显著优势,使得这一疗法极具前景。现在上市的以及即将上市的几款CAR-T都是采用的自体策略,这一疗法显然更具有独特性,并且在目前的安全性数据方面旗鼓相当。
当然,我们期待后续更大规模和更长期的研究来给予更具对比价值的数据!
推荐阅读:
全球第二款上市CAR-T发布最新真实世界数据,目前该领域的市场竞争仍然激烈丨医麦新观察在FDA拒绝BMS/蓝鸟生物的BCMA CAR-T上市申请后,其在欧盟的上市进入审批流程丨医麦猛爆料
参考资料:
1.网页链接
2.网页链接
3.网页链接
4.网页链接
5.网页链接
医麦客近期热门报道
★ 寻找致命脑瘤的解决方案,CD133靶向CAR-T疗法显示出有希望的临床前数据丨医麦猛爆料
★ 峰客浅析丨兔抗的过人之处,国内荃信、奥赛康领跑

点击“阅读原文”,获取重磅干货!