
点击阅读原文,抢先免费报名!

本文由医麦客原创,欢迎分享,转载须授权
2019年12月24日/医麦客 eMedClub/--在2019年的ASH会议上,辉瑞(Pfizer)与Sangamo Therapeutics联合公布治疗严重A型血友病的SB-525基因疗法,在名为Alta的I/II期临床试验中积极的中期结果之后不久,12月23日,Sangamo宣布完成该基因疗法研究性的新药申请(IND)转移,辉瑞将在2020年推进此疗法的III期注册临床研究,并且现已开始招募患者纳入此次研究。根据双方2019年12月对A型血友病基因疗法的全球开发和商业化合作协议修正案的条款,此次IND转移,Sangamo获得了2500万美元的里程碑付款。

SB-525合作成立于2017年5月。根据合作协议的条款,Sangamo负责I/II期临床开发。辉瑞将在运营和财务上负责SB-525的后续研究,开发,制造和商业化活动。此外,Sangamo有资格获得总额高达3亿美元的潜在里程碑付款,用于SB-525的开发和商业化,以及高达1.75亿美元用于开发其他A型血友病基因治疗产品候选产品的费用。此外,Sangamo还将获得从最低的10%到最高20%的SB-525年净销售额的分级版税。
推荐阅读:
8400万美元进军CAR-Treg细胞领域!基因疗法领导者Sangamo盯上了免疫性疾病市场丨医麦黑科技
一扫阴霾?Sangamo/辉瑞公布A型血友病基因疗法早期积极数据,凝血因子水平恢复超出预期丨医麦猛爆料
ASH2019:辉瑞宣布针对A型血友病的1/2期临床试验结果积极,计划启动第3阶段的临床开发丨医麦猛爆料

有关A型血友病的其他研发进展
近两年,除了Sangamo和辉瑞联合开发针对A型血友病的基因疗法之外,其他公司也展现除了对该疾病疗法研发的迅猛趋势,接下来为大家盘一盘有哪些企业。
前不久,拜耳在ASH年会上公布了DTX201的I/II期临床试验的积极结果,数据显示,它能够安全有效地提高凝血因子VIII(FVIII)的水平,并预防或减少了临床试验中前两名重度A型血友病患者的出血状况。除此之外,该公司与瑞士CRISPR Therapeutics公司建立了一家名为Casebia Therapeutics的合资企业,用于研究基于CRISPR/Cas9基因编辑技术的治疗血友病的新型疗法。
ASH2019:拜耳AAV基因疗法在A型血友病的1/2期临床试验结果积极丨医麦猛爆料
Nature子刊:CRISPR/Cas9基因编辑治疗A型血友病,治疗效果持续7个月、且未检测到肝毒性和有意义脱靶丨医麦猛爆料
罗氏(Roche)控股的日本药企中外制药(Chugai)在2019年11月宣布,其在中国台湾的全资子公司已获得台湾食品药品监督管理局(TFDA)对A型血友病新药Hemlibra(emicizumab)的批准。它是一种抗IXa和X的人源化双特异性IgG4单克隆抗体,可模拟FVIII的作用激活天然存在的凝血级联反应,从而恢复血液凝固过程。此药于 2015 年 9 月获得FDA的首个突破性疗法认定,于2017年11月获得正式批准。
今年2月,罗氏宣布以48亿美元收购Spark Therapeutics,这笔交易扩大了罗氏在血友病方面的潜在投资组合。Spark正在开发处于III期临床试验的A型血友病基因疗法SPK-8011,这一收购使罗氏集团手握两款针对A型血友病的领先疗法。
罗氏 Hemlibra 再获 FDA 突破性疗法认定,用于治疗体内不含抑制物的 A 型血友病患者丨医麦优企秀
历时10个月!罗氏48亿美元收购基因治疗巨头Spark终于尘埃落定丨医麦猛爆料
今日,BioMarin公司宣布已向美国FDA递交了valoctocogene roxaparvovec的生物制品许可申请(BLA),用于治疗A型血友病成年患者,此前,该公司已经向欧洲药品管理局(EMA)提交了该疗法的营销授权申请(MAA)。由此可见,该疗法上市在即。
剑指首款A型血友病基因疗法,BioMarin正式向欧洲药品管理局提出上市申请丨医麦猛爆料
此外,今年10月诺和诺德和bluebird联合宣布达成为期三年的合作协议,双方旨在开发治疗遗传疾病的下一代基因组编辑疗法。合作的重点将利用bluebird的基于mRNA的归巢核酸内切酶基因编辑技术--megaTAL技术来开发A型血友病的基因疗法。
诺和诺德与bluebird就血友病基因疗法开发达成合作,各大知名药企不断注入新鲜血液 | 医麦猛爆料

基因疗法领导者:Sangamo Therapeutics
Sangamo成立于1995年,20年来,它一直是基因疗法领域的领导者,致力于通过基因编辑的强大能力生产治疗性蛋白质,把开创性科学转化为对遗传疾病患者产生重大影响的新型基因疗法。2017年公司进行了人体临床试验,包括首次体内人类基因组编辑研究,目前主要进行的临床试验有:分别评估血友病A、血友病B、MPSI和MPSII(粘多糖累积症I型和II型)以及艾滋病毒的治疗安全性和耐受性,其中血友病A与辉瑞公司开展独家全球合作;另外正在招募的临床试验有:Beta-地中海贫血、法布里病以及镰状细胞病(由赛诺菲合作主要)。
与其他基因编辑公司不同的是,Sangamo主要采用ZFN基因编辑技术,其开发的ZFN平台是一款强大的基因编辑技术,可用于特异性敲除基因或将治疗基因插入到精确位置,更是目前基因编辑的三大技术之一(基因组三大编辑技术是指锌指核酸酶(ZFN)、转录激活因子样效应子(TALEN)和规律成簇的间隔短回文重复(CRISPR))。
潜心研究ZFN基因编辑技术20年,Sangamo公司成为行业领导者丨医麦猛爆料

据了解,Sangamo除了通过并购积极扩展研发管线外,在全球范围内也吸引了众多的合作伙伴。此前与英国制药公司Shire合作开发的亨廷顿氏病(HD)基因疗法转向了与武田制药合作,利用ZFP-TF基因组调控平台开发针对病症的疗法;与吉利德的子公司Kite合作开发下一代自体和异体细胞疗法;与赛诺菲合作,利用锌指核酸酶技术(其优势在于不依靠病毒载体对基因进行编辑,从而避免病毒载体可能带来的副作用)开发基因编辑的细胞疗法,以治疗β地中海贫血和镰状细胞病;与辉瑞联合开发治疗A型血友病的基因疗法。
目前,Sangamo利用其独特的技术方法开发了一系列基因组产品线,临床前阶段10项,临床阶段的有5项,其中SB-525即将在辉瑞的带领下进入III期临床。
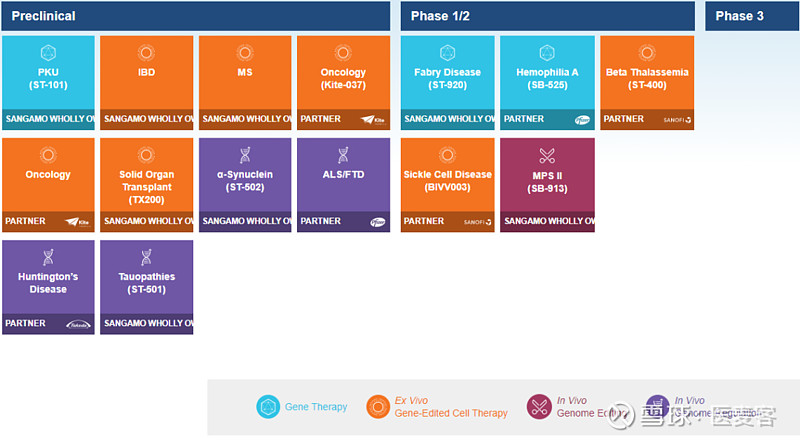
▲Sangamo产品线(图片来源:Sangamo官网)

结语
此次Sangamo的IND转让完成,顺利地与辉瑞患者招募准备相接轨,在A型血友病竞争激烈的当下,辉瑞势必刻不容缓的进行SB-525的III期临床试验,以便加速该药后期申请上市的进程。未来谁与争锋,让我们拭目以待!
参考出处:
1.网页链接
1.网页链接

医麦猛爆料
独家猛爆料:全球首例ips角膜移植手术丨全球首个在体CRISPR临床试验丨Zynteglo获欧盟批准丨大突破-Zolgensma获FDA批准 | ASCO | 地西他滨联合PD-1 | 中国最大License-in | 日本CAR-T获批 | 一天制造CAR-T细胞 | CRISPR美国首次人体试验 | TAC疗法横空出世 | 美国CAR-T医保 | 升级版PD-L1/TGF-β双抗 | PD-1:K药、O药、T药、B药、I药 | 中国首个异基因干细胞产品获批 |
星耀研究院
干货大礼包:iPSC文献大礼包丨基因治疗政策丨外泌体神秘礼包丨溶瘤病毒重量级干货丨ADC药物精华资料丨实体瘤CAR-T最新进展丨全球干细胞政策法规丨双特异性抗体大礼包丨2.29G!CAR-T视频大全集丨30家基因治疗公司PPT(一)丨(二)丨54份制造工艺精华资料丨44份细胞治疗政策及管理规范丨30篇CRISPR重要文献丨2019ASCO全资料下载丨19家顶级CAR-T公司PPT(上) | (下) | 20篇肿瘤免疫高引综述 | 40篇细胞/基因治疗人气文献 | 30+篇细分领域深度报告 | 70篇精选诚意大礼包 | 女王专属大礼包 | 硬核CAR-T大礼包 | 硬核肿瘤免疫大礼包 | 基因治疗“锦鲤”大礼包 |
医麦新观察
行业新观察:干细胞治疗糖尿病丨国内ADC进展丨国内溶瘤病毒公司(上)丨(下)丨干细胞备案丨国内通用CAR-T药企丨通用CAR-T临床进展丨国内外TCR-T公司丨CDMO融资上市 | 溶瘤病毒交易 | 基因治疗-国外 | 基因治疗-国内 | CAR-T新技术 | CAR-T治疗B-ALL | CAR-T治疗B-NHL | 基因工程技术 | BCMA免疫疗法 | CRISPR系统突破技术 | CAR-T工程化功能模块 | 十家专注RNA药企(上) | (下) | 细胞治疗监管法规 |
峰客访谈
产业先行者:精诚医药丨三启生物丨睿健医药丨艾尔普丨霍德生物丨Clindata丨天士力创世杰丨方恩医药丨华龛生物丨西比曼丨Applied StemCell丨华大吉诺因丨瀚思生物丨尚健生物丨艺妙神州丨君实生物丨非同生物丨苏桥生物丨和元上海丨科望医药丨默克丨复宏汉霖丨恒润达生丨颐昂生物丨科济生物丨贝赛尔特丨斯微生物丨中盛溯源丨昭衍生物丨亦诺微丨澳斯康丨复星凯特丨赛诺生丨解放军总医院丨宜明细胞丨博雅控股 | 邦耀生物 | 赛默飞 | GE医疗 | 博雅辑因 | 岸迈生物 | 科医联创 | 金斯瑞 | 普瑞金 | 恒润达生 |
 点一次瘦一斤
点一次瘦一斤