
本文由医麦客原创,欢迎分享,转载须授权
2019年10月16日/医麦客 eMedClub/--干细胞再生医学被誉为继药物治疗和手术治疗之后的第三次医学革命,对很多难治性疾病发挥了良好的治疗作用,如糖尿病(足)、骨关节炎、溃疡性结肠炎、移植物抗宿主病(GVHD)、自身免疫性疾病、慢性牙周炎等。
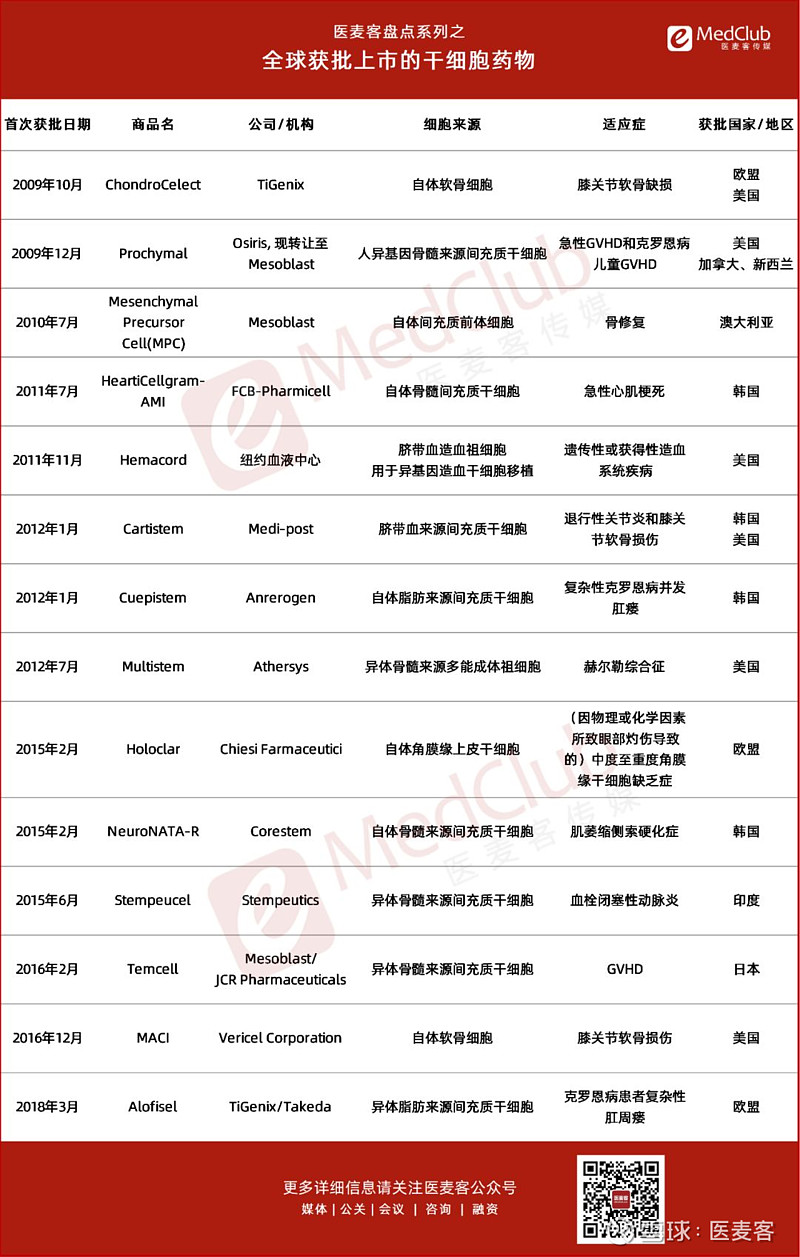
目前,全世界各国已批准上市了十余款干细胞产品,以间充质干细胞为主,国内尚无干细胞产品上市。

全球已上市的干细胞产品
在我国,干细胞按药品、技术管理的“双轨制”监管。企业的干细胞制剂鼓励按药品申报,由国家食品药品监督管理总局(NMPA)监管;医疗机构主导的生物医学新技术,即医院制剂可按医疗技术进行管理,由卫健委监管。
因此,谈及我国干细胞治疗的临床进展,可以从干细胞临床研究备案项目和干细胞新药临床研究两个角度出发。

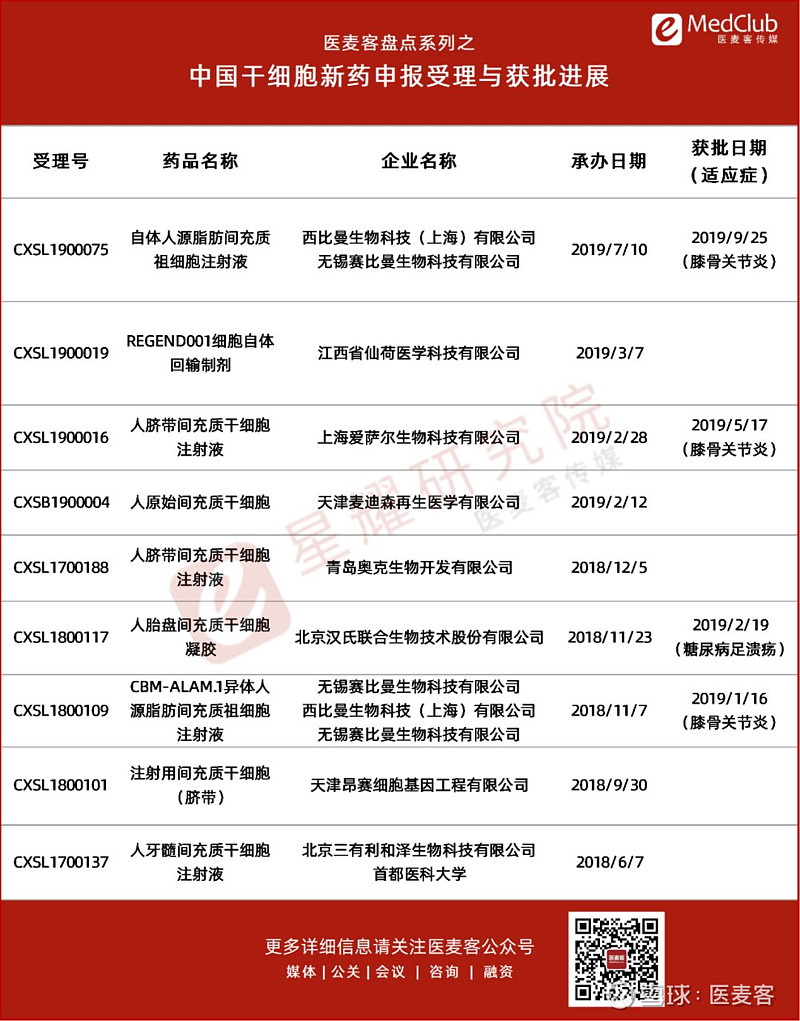
CDE已受理9款干细胞新药
2017年发布的《药品注册管理办法(修订稿)》明确指出细胞治疗类产品可以按药品进行注册上市,紧接着《细胞治疗产品研究与评价技术指导原则(试行)》的颁布,更加明晰了细胞治疗作为药品申报的标准。
2018年6月至今,国内相继有9款干细胞新药的IND申请获国家药品审评中心(CDE)正式受理,除了江西省仙荷医学科技有限公司自主研发的REGEND001细胞自体回输制剂为自体肺基底层上皮细胞外,其它8款均为间充质干细胞。截止目前,国内已有4款干细胞新药IND获得临床默示许可,分别是胎盘、脐带、异体/自体脂肪来源的间充质干细胞,适应症分别为糖尿病足溃疡、膝骨关节炎和膝骨关节炎。
其中,西比曼生物科技(上海)有限公司拥有两项干细胞新药的临床默示许可,包括CBM-ALAM.1异体人源脂肪间充质祖细胞注射液(AlloJoin®)和自体人源脂肪间充质祖细胞注射液(ReJoin®),均用于治疗膝骨关节炎。
推荐阅读:西比曼生物获第二项干细胞新药默示许可,自体人源脂肪间充质祖细胞治疗膝骨关节炎丨医麦猛爆料

干细胞临床研究备案机构和项目
2019年初,国家卫生健康委员会和国家药品监督管理局联合印发了《关于做好2019年干细胞临床研究监督管理工作的通知》。
通知中明确:2019年,国家卫生健康委、国家药监局将继续每个季度组织一次干细胞临床研究机构和项目备案材料审核。自2019年起,干细胞临床研究机构与项目备案将实行动态管理,已经备案的干细胞临床研究机构到2020年底仍无研究项目备案的,应当重新提交机构备案材料,未履行重新提交备案材料程序的视为自动放弃备案。
今后,干细胞临床研究机构和项目备案将结合进行。拟开展干细胞临床研究的机构,应当将完整的机构备案材料和项目备案材料一并经省级卫生健康行政部门和药品监管部门审核后,报国家卫生健康委、国家药监局备案。

2019年3月29日,卫健委发布了《体细胞治疗临床研究和转化应用管理办法(试行)》(征求意见稿),解读文件中明确要求:按照本管理办法有关规定,开展体细胞治疗临床研究和转化应用的医疗机构应当进行备案,医疗机构进行首次机构备案时,须同时提供医疗机构备案材料和临床研究项目备案材料。
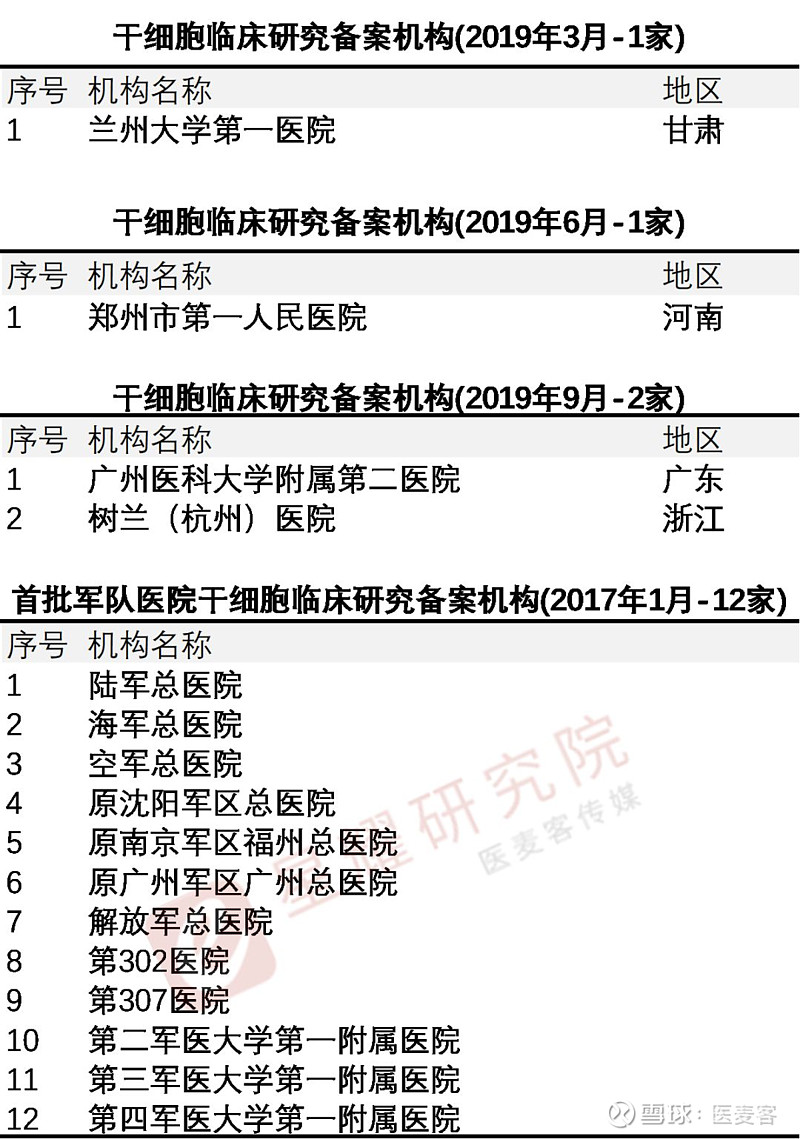
也就是说,国家加大了对干细胞研究的监管力度,规范干细胞临床研究体系,实行了干细胞临床研究机构备案和干细胞临床研究项目备案,也称为“双备案”制度。截至目前,兰州大学第一医院、郑州市第一人民医院、广州医科大学附属第二医院和树兰(杭州)医院已完成“双备案”。
2019年9月,按照《干细胞临床研究管理办法(试行)》(国卫科教发〔2015〕48号)的规定,以及《关于做好2019年干细胞临床研究监督管理工作的通知》(国卫办科教函〔2019〕169号)文件精神,又有2家干细胞临床研究机构和11个干细胞临床研究项目完成备案。至此,国家批准干细胞临床治疗研究医院增至106家,军队系统的医院批准的共12家,一共118家机构;备案项目增至62个。
 干细胞临床研究备案机构名单
干细胞临床研究备案机构名单

 干细胞临床研究备案项目名单
干细胞临床研究备案项目名单

结语
现如今全球干细胞产业正进入高速发展期,据博思数据预计,到2024年全球干细胞医疗的潜在市场规模将达到3614亿美元。
监管政策的完善落地将规范干细胞治疗的临床转化,并指引该领域的发展方向。在我国,各省市也相继出台利好政策。例如,上海近日出台了《上海市新一轮服务业扩大开放若干措施》,其中提到,要推进医疗科技领域的项目合作和取消外资准入限制,争取允许外商投资人体干细胞、基因诊断与治疗技术开发和应用。
再生医学的治疗潜力无需多言,但将其转化到临床应用仍任重道远!
参考出处:
CDE官网、中国医药生物技术协会
生物云智库:【0003】干细胞临床研究项目备案初探
干细胞储存和临床应用工程中心. 国内已受理的7款干细胞新药:你想知道的都在这里

医麦猛爆料
独家猛爆料:全球首例ips角膜移植手术丨全球首个在体CRISPR临床试验丨Zynteglo获欧盟批准丨大突破-Zolgensma获FDA批准 | ASCO | 地西他滨联合PD-1 | 中国最大License-in | 日本CAR-T获批 | 一天制造CAR-T细胞 | CRISPR美国首次人体试验 | TAC疗法横空出世 | 美国CAR-T医保 | 升级版PD-L1/TGF-β双抗 | PD-1:K药、O药、T药、B药、I药 | 中国首个异基因干细胞产品获批 |
星耀研究院
干货大礼包:iPSC文献大礼包丨基因治疗政策丨外泌体神秘礼包丨溶瘤病毒重量级干货丨ADC药物精华资料丨实体瘤CAR-T最新进展丨全球干细胞政策法规丨双特异性抗体大礼包丨2.29G!CAR-T视频大全集丨30家基因治疗公司PPT(一)丨(二)丨54份制造工艺精华资料丨44份细胞治疗政策及管理规范丨30篇CRISPR重要文献丨2019ASCO全资料下载丨19家顶级CAR-T公司PPT(上) | (下) | 20篇肿瘤免疫高引综述 | 40篇细胞/基因治疗人气文献 | 30+篇细分领域深度报告 | 70篇精选诚意大礼包 | 女王专属大礼包 | 硬核CAR-T大礼包 | 硬核肿瘤免疫大礼包 | 基因治疗“锦鲤”大礼包 |
医麦新观察
行业新观察:国内ADC进展丨国内溶瘤病毒公司(上)丨(下)丨干细胞备案丨国内通用CAR-T药企丨通用CAR-T临床进展丨国内外TCR-T公司丨CDMO融资上市 | 溶瘤病毒交易 | 基因治疗-国外 | 基因治疗-国内 | CAR-T新技术 | CAR-T治疗B-ALL | CAR-T治疗B-NHL | 基因工程技术 | BCMA免疫疗法 | CRISPR系统突破技术 | CAR-T工程化功能模块 | 十家专注RNA药企(上) | (下) | 细胞治疗监管法规 |
峰客访谈
产业先行者:尚健生物丨艺妙神州丨君实生物丨非同生物丨苏桥生物丨和元上海丨科望医药丨默克丨复宏汉霖丨恒润达生丨颐昂生物丨科济生物丨贝赛尔特丨斯微生物丨中盛溯源丨昭衍生物丨亦诺微丨澳斯康丨复星凯特丨赛诺生丨解放军总医院丨宜明细胞丨博雅控股 | 邦耀生物 | 赛默飞 | GE医疗 | 博雅辑因 | 岸迈生物 | 科医联创 | 金斯瑞 | 普瑞金 | 恒润达生 |
 点一次瘦一斤
点一次瘦一斤