
 本文由医麦客原创,欢迎分享,转载须授权
本文由医麦客原创,欢迎分享,转载须授权
2019年6月8日/医麦客 eMedClub/--近年来,基因改造的免疫细胞被应用于临床,作为一种“活的药物”颠覆了部分血液癌症的治疗。临床经验表明,体外基因转移是安全可行的,可以发挥显著和持久的抗肿瘤作用。然而,现阶段也存在一些障碍,例如实体瘤疗效不佳、制造复杂以及相应的高昂成本。
为此,研究人员正在测试细胞疗法靶向多种抗原、与小分子药物和其他标准疗法相结合,或者设计下一代过继性细胞,如动态合成抗原受体、引入多种转基因、或将抗原受体与基因编辑技术相结合以删除某些基因。
近日,在权威期刊Nature Biotechnology上,来自马萨诸塞州总医院癌症中心的研究人员探讨了将合成生物学与基因编辑相结合的当前和潜在策略,这些策略正在用于开发免疫细胞(T细胞、自然杀伤(NK)细胞、单核细胞)、造血干细胞(HSC)和诱导多能干细胞(iPSC)的细胞疗法。

 基因编辑技术在细胞疗法的应用
基因编辑技术在细胞疗法的应用
基于基因编辑的通用T细胞
 迄今为止,免疫细胞的基因工程作为一种治疗模式,主要集中在使用通过基因导入特定抗原受体而重定向到癌症靶标的T细胞,这些受体要么基于天然T细胞抗原受体(TCRs),要么基于融合到T细胞信号域的抗体,如嵌合抗原受体(CARs)。
迄今为止,免疫细胞的基因工程作为一种治疗模式,主要集中在使用通过基因导入特定抗原受体而重定向到癌症靶标的T细胞,这些受体要么基于天然T细胞抗原受体(TCRs),要么基于融合到T细胞信号域的抗体,如嵌合抗原受体(CARs)。
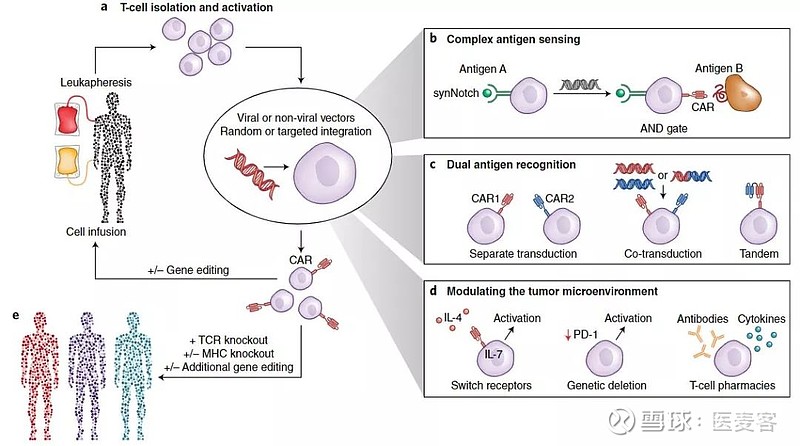 ▲ T细胞免疫编辑策略(图片来源:Nature Biotechnology)
▲ T细胞免疫编辑策略(图片来源:Nature Biotechnology)
从耐受性和免疫原性的角度来看,自体T细胞策略很简单,但在制造时间和与为每位患者生成自体工程化T细胞相关的成本方面,临床上存在很大障碍。此外,患者由于疾病进展和化疗等原因,不能满足进行治疗所需的T细胞数量和质量阈值,极大地限制了自体疗法的适用范围。
通用供体的同种异体T细胞成为趋势,但存在两个主要缺陷:第一,由于不完全消除携带TCR的T细胞,导致移植物抗宿主病(GvHD)的潜在风险;第二,由于输注的T细胞排斥导致其扩增和持续性降低,可能会降低疗效,预计这些T细胞仍会表达同种异体抗原,包括人类白细胞抗原(HLA)。
第一个障碍可能通过使用γδT细胞来解决,这些细胞不被认为会导致GvHD,并且天然来源于粘膜和上皮组织。然而,从外周血中回收足够数量的这些细胞作为起始材料是一项挑战。
几个研究小组使用基因编辑工具TALENs、归巢内切核酸酶和CRISPR-Cas敲除了内源性TCRs,或者用megaTALs、锌指核酸酶(ZFN)、CRISPR或TALENs敲除了TCR。但应该注意的是,根据骨髓移植临床经验,即使是小的TCR表达T细胞污染群也有可能在免疫功能低下的患者中扩大,GvHD可能是一种非常严重的并发症。
相反,关注HLA表达修饰的报道有限,但临床前研究已经研究了使用ZFN和CRISPR-Cas消除HLA标记的可能性。需要更多的研究来确定HLA(A、B和C)的缺失是否需要伴随HLA-E的替代以避免NK细胞介导的杀伤。
多项临床试验正在使用TALEN介导的TCR敲除CAR-T细胞用于治疗恶性肿瘤。2018年12月,美国血液学会(ASH)年会上提供的数据表明,虽然通过预先输注特定药剂可以降低GvHD的风险,但是只要体内存在自体T细胞,输注的现成T细胞就不太可能持续存在。
然而,在持续缓解不依赖于CAR-T细胞持续存在的疾病中,这些通用方法可以得到大大推进,并显著增加有资格接受T细胞疗法的患者数量。需要记住的一个问题是,随着引入的基因编辑数量的增加,易位和脱靶突变的可能性可能会增加。
在研药企/机构
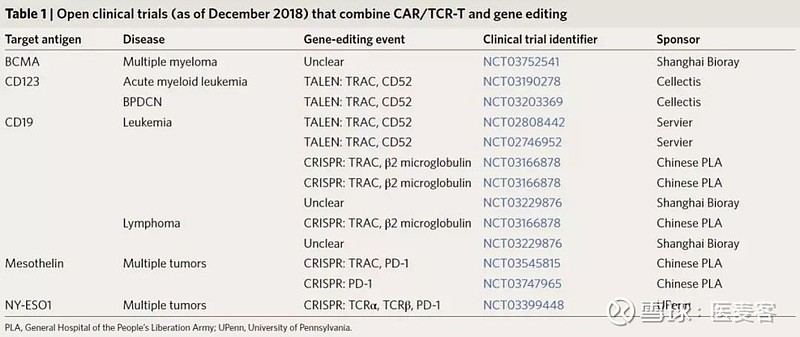 ▲ (截至2018年12月)将CAR/TCR-T和基因编辑相结合的临床试验(图片来源:Nature Biotechnology)
▲ (截至2018年12月)将CAR/TCR-T和基因编辑相结合的临床试验(图片来源:Nature Biotechnology)
今年4月,美国宾夕法尼亚大学的研究团队宣布,已经开启了基于CRISPR治疗癌症的临床试验。现已有两名癌症患者接受了基于CRISPR技术改造过的T细胞疗法的治疗,其中一名患有多发性骨髓瘤,另一名患有肉瘤。这是美国首批接受基于CRISPR疗法的患者!
早在2016年年中,该团队就已经获得了美国FDA的批准,可以推进他们的试验。然而,直到2018年初,他们才谨慎登记该试验。
推荐阅读:CRISPR在美国首次用于人体试验丨医麦猛爆料
法国 Cellectis 公司,其基于Talent基因编辑技术的细胞疗法就是现在全球临床进展最快的通用CAR-T(UCART)。目前,公司在研的通用型CAR-T产品包括四个靶点,分别为CD19、CD123、CD22以及CS1。其中,最成熟的UCART19经过辉瑞、Servier等多家公司授权,美国市场的开发和商业化已转于Allogene负责,Servier负责全球其他国家和地区的市场。
推荐阅读:
Cellectis公司第3款通用型CAR-T疗法UCART22获美国FDA批准进入临床丨医麦猛爆料
突破!Cellectis开发的这款带有嵌入式安全开关的「一体化」CAR结构,有望再度革新细胞治疗丨医麦黑科技
CRISPR Therapeutics在去年AACR年会上公布了其公司在研同种异体CAR-T细胞项目的最新研究数据,证明了通过CRISPR基因编辑技术对于靶向BCMA和CD70的CAR-T细胞具有较高的编辑率、一致性表达、选择性以及强大的细胞杀伤力。
早在2017年11月的癌症免疫治疗协会(SITC)年会上,该公司首次公布了基于CRISPR开发的同种异体CAR-T临床前研究结果。包括CD19 CAR-T、CD70 CAR-T以及BCMA CAR-T。
推荐阅读:深度解读:基因编辑上市公司首次公布基于CRISPR开发的同种异体CAR-T临床前研究结果丨医麦猛爆料
工程NK细胞和巨噬细胞
 由于NK细胞天生具有细胞溶解功能、抗病毒和抗肿瘤免疫功能,但缺乏可能导致GvHD的TCRs,因此利用特定的抗原受体对NK细胞进行基因改造,具有不需要基因编辑的现成细胞治疗潜力。
由于NK细胞天生具有细胞溶解功能、抗病毒和抗肿瘤免疫功能,但缺乏可能导致GvHD的TCRs,因此利用特定的抗原受体对NK细胞进行基因改造,具有不需要基因编辑的现成细胞治疗潜力。
基因工程NK细胞已被证明更具挑战性。通过电穿孔将mRNA导入从外周血或脐带血中分离的NK细胞的尝试仅产生了
CAR-NK细胞具有基因重定向NK细胞的能力,已用于多种恶性肿瘤的临床前研究,包括多发性骨髓瘤、胶质母细胞瘤、肾细胞癌、Her2+癌、B细胞和T细胞肿瘤。
在缺乏高水平IL-2或IL-15的情况下,NK细胞的寿命相对有限,这对某些恶性肿瘤来说可能不是最佳选择,但在靶向可再生或可回收的正常组织(如造血细胞)上表达的抗原方面具有潜在优势。令人鼓舞的是,CAR-NK治疗临床疗效的早期数据表明,CD19 CAR转导的脐带血来源的NK细胞可作为B细胞恶性肿瘤患者的现成的刺激剂,安全有效地使用。
和NK细胞一样,巨噬细胞也是先天免疫系统的一部分。与NK细胞不同,巨噬细胞起源于髓样细胞,存在于所有组织中,专门吞噬细胞,并产生调节先天免疫细胞和适应性免疫细胞的细胞因子。
 ▲ 免疫疗法中的巨噬细胞:双管齐下(图片来源:Nature Biotechnology)
▲ 免疫疗法中的巨噬细胞:双管齐下(图片来源:Nature Biotechnology)
一方面,由于它们通过细胞因子产生可以影响适应性免疫细胞,基因工程巨噬细胞(GEM)可作为肿瘤特异性T细胞的支持系统。
慢病毒转导的巨噬细胞可产生能够分泌可溶性转化生长因子-β(TGFβ)受体的GEM,其通过“捕获”抑制性细胞因子TGFβ而减少肿瘤微环境中的局部免疫抑制。该方法还允许GEM产生IL-21,其可以激活肿瘤部位的NK细胞和T细胞。
另一方面,巨噬细胞在免疫防御中的主要功能是吞噬作用,即吞噬其他细胞和颗粒。癌细胞自有逃脱妙招 - 上调“不吃我”信号,如CD47,最终阻止巨噬细胞识别和吞噬它们。CD47在多种恶性肿瘤中过表达,并且在与信号调节蛋白-α(SIRP-α)结合后,保护肿瘤细胞免于吞噬作用。
靶向CD47和SIRP-α的抗体显示出对正常细胞的毒性并且无法分别穿透实体瘤。与未经编辑的巨噬细胞相比,CRISPR-Cas9和精氨酸包被的金纳米颗粒介导的吞噬细胞中SIRP-α的失活促使对骨肉瘤细胞的靶向性提高四倍。这些发现表明,GEMs上SIRP-α表达的减少可以作为增加肿瘤细胞识别和吞噬细胞凋亡的免疫治疗策略。
在研药企/机构
2018 AACR年会上,Fate Therapeutics的肿瘤免疫治疗副总裁—Bob Valamehr博士公布了FT819的临床前研究结果,彰显特异性、功能性以及有效性。
这是一款off the shelf、TCR-less(完全消除TCR)的CD19 CAR-T细胞产品,并且用于生产制造FT819的主细胞系是iPSC。与自体(使用来自患者自身的细胞)和同种异体(使用来自捐献者的细胞)方法相比,使用主iPSC系生产的CAR-T细胞具有明显的优势。其中包括:主iPSC系拥有无限的自我更新能力,并且可以进行储存和可再生使用。Valamehr及其同事使用他们先前开发的专利平台创建主iPSC系。
工程造血干细胞和非造血干细胞
 正如脐带血来源的NK细胞可能比成熟的免疫细胞更适合成为现成的产品,干细胞的基因修饰在基因编辑、选择和临床适应症方面具有进一步的通用性。
正如脐带血来源的NK细胞可能比成熟的免疫细胞更适合成为现成的产品,干细胞的基因修饰在基因编辑、选择和临床适应症方面具有进一步的通用性。
尽管使用成熟T细胞的TCR和CAR-T细胞疗法在临床上取得了成功,但添加自我更新的T细胞群有可能增强细胞持久性,从而可能延长缓解的持久性。此外,制造具有特定表型的细胞群的能力提供了同种异体的、现成的、大规模生产的潜力,以便用单批细胞疗法用于许多患者。
因此,诱导多能干细胞(iPSCs)已被用于再生表达内源性TCR的肿瘤特异性T细胞,以及产生携带CAR的肿瘤特异性iPSC T细胞系(T-iPSC)。与T-iPSC一样,最原始的血液细胞系HSC也被用于基于TCR和基于CAR的治疗。iPSC或HSC衍生的肿瘤特异性T细胞的结果将有助于更好地理解这些方法的可行性和潜在毒性。
 ▲ 用于癌症治疗的工程干细胞(图片来源:Nature Biotechnology)
▲ 用于癌症治疗的工程干细胞(图片来源:Nature Biotechnology)
作者指出,有效产品可能会出现靶相关毒性,如B细胞再生障碍或细胞因子释放综合征,同时应注意潜在的基因组和细胞毒性。基因组毒性可能是由于需要增加双链断裂和基因组操作的数量,以及大规模生产所需的大量细胞分裂;如果iPSC保留未分化的增殖或异常运输,则可能发生细胞毒性。这些潜在的毒性原则上可以通过在输注到患者之前对细胞进行深度遗传和表型分析来最小化。
除了产生T细胞,iPSC还可以用于产生其他免疫细胞,例如NK细胞、树突细胞(DCs)和巨噬细胞。为了避免鉴定、分离和扩增足够数量的成熟树突细胞的复杂性,已经使用iPSC在体外产生DC(iPS-DC)。初步研究表明,载有巨细胞病毒(CMV)衍生肽的iPS-DC能够在体外诱导CMV特异性CD8+ T细胞的强烈扩增。
在研药企/机构
今年2月,美国首次使用 iPSC中取的细胞进行一项“现货”NK免疫治疗临床试验。来自加州大学圣地亚哥医学院的研究人员与Fate Therapeutics合作,研究FT500在晚期实体肿瘤患者中的单独作用以及与检查点抑制剂的联合作用,将包括多达64名晚期癌症患者。
FT500,即一种来自克隆主的由iPSC衍生的同种异体NK细胞治疗免疫疗法。使用克隆主iPSC系来生产FT500,提供了大量同源的NK细胞群,并明确显示出了有效活性以及与T细胞协同作用的能力。
推荐阅读:Fate在研iPSC衍生产品FT500获FDA批准IND,NK细胞产品临床开发新时代到来 | 医麦猛爆料
非造血干细胞也可通过遗传修饰用于各种目的,包括用于释放酶或前药治疗(将前药转化为局部环境中的细胞毒性分子)。
成人干细胞、神经干细胞(NSCs)和间充质干细胞(MSCs)的两个谱系已被设计为将酶递送至局部肿瘤部位。在NSCs和MSC释放酶后,前体药物转化为毒性变体,已显示其可减缓脑恶性肿瘤的生长。
临床前研究的成功促使首个使用克隆人NSC细胞系HB1.F3的人类临床试验(NCT01172964),其被工程化以表达胞嘧啶脱氨酶。第二个临床试验(NCT02015819)正在进行中,使用工程化NSCs治疗神经胶质瘤的。
局部递送治疗,例如药物、病毒和纳米颗粒,对于在肿瘤部位引发反应可能是至关重要的。工程化MSCs和NSCs包封和释放抗肿瘤剂,如TNF-α相关凋亡诱导配体(TRAIL)和IFN-β,分别延缓胶质母细胞瘤和乳腺癌的生长。重要的是,这些治疗剂的水平在局部肿瘤微环境中升高,但在整个循环中没有升高,因此验证了它们作为局部药物递送剂的作用。
除药物释放外,MSCs和NSCs还可以提供溶瘤病毒。在脑肿瘤中,溶瘤性单纯疱疹病毒的NSC介导的和MSC介导的递送促使病毒摄取肿瘤细胞和小鼠模型存活增加。当递送减毒麻疹病毒时,工程化MSCs也成功地完全抑制了肝细胞癌的生长,这表明该方法可广泛用于各种癌症类型。最后,NSCs和MSCs已被鉴定为纳米颗粒载体的有效递送系统。MSCs不仅可以内化和传递纳米粒子,而且还可以保护纳米粒子免受宿主免疫监视和单核细胞的吞噬。CAR工程化的成熟人T细胞也可用于将纳米颗粒递送至肿瘤微环境。
 癌症之外的免疫细胞工程
癌症之外的免疫细胞工程
细胞工程所带来的创造性创新,以及它们对癌症的显著而持久的疗效,给了我们希望,未来这些方法可以推广到其他疾病。免疫细胞疗法在对抗感染性疾病、促进移植后耐受或自身免疫性疾病方面具有特殊的潜力。除了HIV感染,与癌症相比,细胞疗法针对这些适应症处于早期阶段,而大多相关公开数据是临床前的。
基于T细胞的方法可以通过设计促进耐受性的T细胞亚群(如Treg细胞),或通过专门针对致病免疫细胞来促进耐受性。TCR和CAR构建物都可以导入Treg细胞,以抑制免疫反应和保护组织结构,或被设计成产生免疫抑制细胞因子,如IL-10。嵌合自身抗体受体T细胞(CAAR-Ts)已在寻常天疱疮的临床前模型中显示出对自身反应性B细胞的有效细胞毒性。Roth等人最近的研究表明,CRISPR-Cas9系统可以直接修复与T细胞功能相关的基因突变。具体来说,利用CRISPR技术修复了对Treg发育和功能至关重要的IL2RA基因突变,从而恢复了人类Treg细胞中的细胞信号。这些研究为免疫细胞工程提供了一系列令人兴奋的机会,以改善并可能治愈自身免疫性疾病。
第一批CAR-T细胞产品(以CD4为靶点)和基因编辑产品(用锌指核酸酶破坏CC-基序趋化因子受体5(CCR5))是在目前广泛使用的抗逆转录病毒治疗之前开发出来的,用于对抗HIV。这些临床试验的数据现在已经获得了多年,并证明CD4-ζT细胞和CCR5基因编辑T细胞能够长期维持。
在研药企/机构
Sangamo Therapeutics拥有两个自行研发针对HIV感染的细胞治疗项目,分别是基于ZFN基因编辑的自体T细胞候选产品SB-728-T、以及SB-728mR-HSPC。目前这两个产品均处于I/II期临床试验阶段,将通过ZFN基因编辑删除CCR5(这种CCR5蛋白是某些类型的HIV进入和感染T细胞所必需的)。
T细胞是身体用来对抗HIV的白细胞之一,其中最重要的是CD4+ T细胞。SB-728-T疗法将通过ZFN对患者体内采集的CD4+ T细胞进行遗传修饰以删除CCR5基因,再回输至患者体内以抵抗HIV感染。
SB-728mR-HSPC是一种CCR5修饰的自体CD34 +造血干/祖细胞产品,临床试验将评估该疗法针对正在接受联合抗逆转录病毒治疗(cART)治疗并且检测不到病毒,但CD4+ 细胞水平不佳的HIV-1(R5)感染患者的安全性和可行性。
此外,其它临床试验发起者和合作方还包括宾夕法尼亚大学、希望之城医疗中心,均在评估ZFN基因编辑技术在HIV感染适应症上的安全性和有效性。
 展望
展望
随着首批T细胞疗法的批准,我们得以进入这个领域的尖端。凭借临床疗效的希望和基因转移、基因编辑和合成免疫学领域的一系列创新,该领域逐步迈向成熟,通过利用深度个性化(例如,肿瘤突变特异性细胞)或大规模生产(例如,现成的细胞疗法)的各种细胞类型,快速扩展对抗一系列癌症类型和其他适应症的新策略。
尽管无法预测哪种方法最终会在临床和市场上取得成功,但我们相信基因转移和基因编辑技术在细胞治疗中的应用将在未来几年内彻底改变医学实践。同种异体、现成的细胞策略将在临床试验中得到验证,我们也可以看到该领域的扩展,包括自然杀伤细胞和诱导多能干细胞的进一步基因工程。
细胞治疗的现成方法的增长主要是由工业和细胞治疗的商业化驱动的。随着这些试验数据的积累,科学界将了解到现成方法的普遍性是否有限制,以及一旦细胞被归还给患者,基因编辑的局限性和优势将是什么。
 参考出处:
参考出处:
 医麦猛爆料
医麦猛爆料
大突破-Zolgensma®获批 | ASCO | 地西他滨联合PD-1 | 中国最大License-in | 日本CAR-T疗法获批上市 | 一天制造CAR-T细胞 | CRISPR美国首次人体试验 |TAC疗法横空出世 | 美国CAR-T治疗纳入医保 | 升级版PD-L1/TGF-β双抗 | PD-1:K药、O药、T药、B药、I药 | 中国首个异基因干细胞产品获批 |
医麦干货集
19家顶级CAR-T公司PPT(上) | (下) | 20篇肿瘤免疫高引综述 | 40篇细胞/基因治疗人气文献 | 30+篇细分领域深度报告 | 70篇精选诚意大礼包 | 女王专属大礼包 | 硬核CAR-T大礼包 | 硬核肿瘤免疫大礼包 | 基因治疗“锦鲤”大礼包 |
医麦大盘点
CDMO融资上市 | 溶瘤病毒交易 | 基因治疗-国外 | 基因治疗-国内 | CAR-T新技术 | CAR-T治疗B-ALL | CAR-T治疗B-NHL | 基因工程技术 | BCMA免疫疗法 | CRISPR系统突破技术 | CAR-T工程化功能模块 | 十家专注RNA药企(上) | (下) | 临床试验 | 细胞治疗监管法规 |
峰客访谈
博雅控股 | 邦耀生物 | 赛默飞 | GE医疗 | 博雅辑因 | 岸迈生物 | 科医联创 | 金斯瑞 | 普瑞金 | 恒润达生 |

 点一次瘦一斤
点一次瘦一斤
