
国内刚刚因为CAR-T产品能降到百万元以下而兴奋不已,FDA转身倒了一盆冷水。
11月28日,美国FDA发文表示,将对在美获批上市的全部CAR-T疗法展开安全性调查。

注意,是全部。不管是明星产品,还是后辈新秀,通通要接受调查。
目前,美国市场已批准上市6款CAR-T疗法,分为靶向CD19和BCMA两种技术路线,适应症全部面向血液系统肿瘤疾病。
FDA表示,两种技术路线下的产品, 其均有收到患者用药后出现T细胞恶性肿瘤的报告。
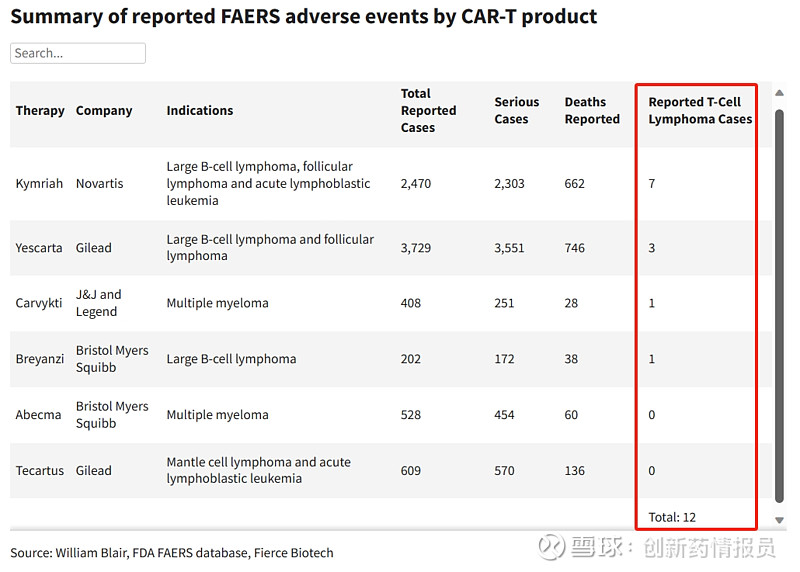
实际上,继发性肿瘤的潜在风险,早已被列为CAR-T疗法的类别警告之一。但FDA依然做出了对全部产品进行安全性调查的决定。
这是一个值得深思的信号。
FDA的消息一出,相关企业很快做出积极面的回应。
吉利德公司对媒体表示,公司的Tecartus和Yescarta两种疗法已在17700名患者中应用,迄今为止没有证据表明他们与新恶性肿瘤的发展之间存在因果关系。
诺华针对其Kymriah秉持了相似的态度:这款产品治疗了近10000多名患者,尚未确定Kymriah与继发性恶性肿瘤之间的因果关系。
BMS回应称,在使用Abecma或Breyanzi进行治疗的4700名患者中,没有人患上CAR阳性T细胞恶性肿瘤。目前公司正在回应FDA的诉求。
相比之下,传奇生物的回应更直接,其表示:即使没有用CAR-T治疗,多发性骨髓瘤患者也可能发生T细胞恶性肿瘤。
总结来看,企业们都是一个意思:当前的CAR-T疗法,确实会伴随有继发性恶性肿瘤的发生,但这与公司产品未必相关啊。
从原理上来看,CAR-T疗法确实是有一定风险性。
FDA在公告中表示,与其他基因治疗产品类似,目前市场上的CAR-T都是使用整合载体,如慢病毒或逆转录病毒载体来修饰细胞,进而达到靶向特定癌症细胞的作用。但这意味着存在脱靶风险,可能会产生突变,导致癌症的发生。
考虑到种种风险,即便是已经获批上市多款产品,FDA还是决定要进行大规模安全性调查。
FDA的动作,似乎指明了行业发展要考量的重点之一:在细胞与基因,甚至更加广袤的领域,载体的作用正日渐关键。
优质的载体,会提高药物的生物利用度、延长药物作用时间、实现药物体内靶向定位、降低毒副作用等;而如果载体不够好,则可能会出现识别不了靶标,威胁正常细胞,也就会给患者带来新的致病风险。
目前的药物载体主要分为两类,一类是病毒载体,如逆转录病毒、慢病毒、腺相关病毒等,这些常在细胞与基因治疗中出现;另一类是非病毒载体,如质粒、脂质体、纳米颗粒,以及mRNA疫苗产业链中高频出现的脂质纳米粒等。
它们都各有优缺点。
随着生命科学研究的持续拓深,研究出更优质的药物载体,可能会成为接下来创造传奇的关键。
实际上,市场有关的动向已在逐步露出。
今年年初,上海儿童医学中心相关团队针对治疗性mRNA应用过程中缺乏安全有效的递送载体这一难题,开发出两种高效低毒载体ALL-Fect和Leu-Fect C;
4月份,重庆医科大学研究者们发表研究结果显示,可以运输DNA、RNA、生物活性蛋白、葡萄糖链和代谢产物等的外泌体,在细胞间的通讯中发挥直观重要的作用,作为药物递送载体和液体活检生物标志物前景广阔;
11月份,成立仅1年,主攻新型药物递送技术的Nvelop Therapeutics拿到1亿美元种子轮融资……
不过,这个领域在国内受关注度并不高,发展较慢。当下该加加速了。