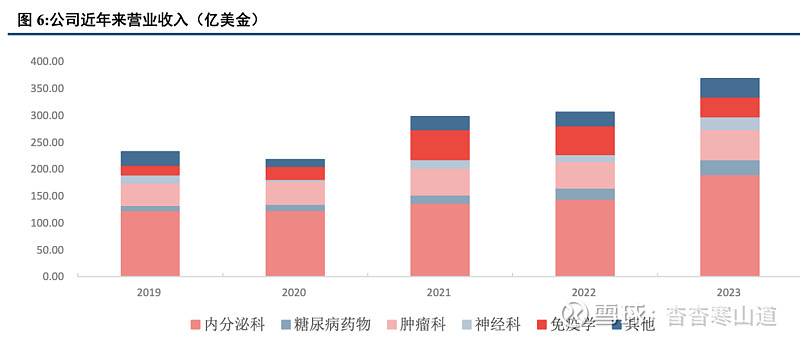
公司近年来营收增长强劲,业绩表现亮眼。
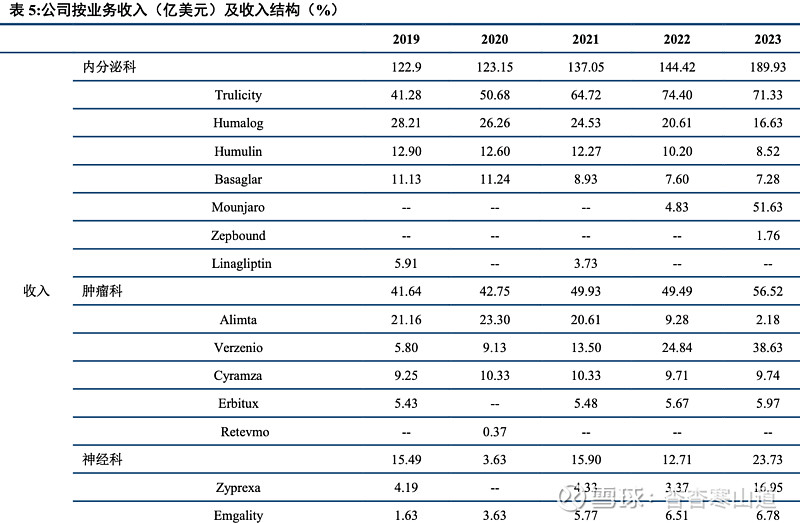
公司在GLP-1领域布局的重磅药物Mounjaro自上市来销售额迎来高增长,2023年已实现51.63亿美元的销售额,2024年销售额更有望突破100亿美元。
整体看,公司在代谢、自免和肿瘤等多个领域布局广泛,公司传统产品如Taltz、Jardiance和Verzenio等依旧保持强劲增长态势,而新产品Tirzepatide、Lebrikizumab和Jardiance等未来可期。
随着GLP-1类药物管线在未来的持续放量,看好公司未来发展;
公司近年营收增长强劲,新旧产品协同增长
公司作为国际制药企业,深度布局代谢、肿瘤、自免和神经领域,尤其在代谢领域傲视群雄。全球超重及肥胖人群超二十亿,人群庞大,减肥药物市场空间广阔,商业化可期。
2019年以来,公司营收增长稳步提速;在营收高基数的前提下,近五年仍保持10%的年复合增速;其中,2023年营收同比增长19.56%,实现营收341.24亿美元。公司传统产品如Taltz、Jardiance和Verzenio等依旧保持强劲增长态势,而新产品Tirzepatide、Lebrikizumab和Jardiance等未来可期。整体看,公司管线布局广泛,新旧产品均具备强竞争力,未来发展可期。
代谢领域布局广泛,糖尿病+减肥双赛道持续成长
公司在代谢领域的布局药物众多,涵盖减肥、糖尿病和肾病等适应症。目前随着公司核心产品GLP-1R/GIPR激动剂药物Mounjaro上市后逐季度高增长,公司在糖尿病以及减重赛道已经迎来深厚回报。我们认为,公司在GLP-1类药物中的布局十分广泛,产品类型多样,看好公司代谢领域后续管线发展。
自免与肿瘤领域持续推进,新产品有望带来新增长动力
在自免领域,公司核心产品Taltz在银屑病适应症上具备良好疗效,产品已实现超20亿美金销售额,持续稳定放量。同时,创新型IL-13抗体药物Lebrikizumab即将在美上市,有望为特应性皮炎患者带来新用药选择。肿瘤领域,公司Verzenio和Tyvyt持续放量,同时创新型第三代BTKi产品Jardiance也将为公司肿瘤管线增加新收入。整体看,公司自免与肿瘤领域布局广泛,新产品有望带来新贡献
神经领域稳步发展,创新AD药物Donanemab有望迎来上市销售
在神经领域,公司稳步推进发展。偏头痛药物Emgality已上市销售并为公司持续贡献收入回报。同时,创新型阿尔兹海默病药物Donanemab有望于2024年在美获批上市销售,为AD患者带来全新用药选择的同时也为公司带来新增长动力。

历史悠久,公司持续推进发展
百年全球制药巨头,稳中求进迎突破,代谢及神经领域领先。礼来公司由礼来上校成立于1876年,有140余年的研发与制药历史。1952年,礼来公司在美国挂牌上市。20世纪80年代以来,公司先后研发出DNA重组技术生产的药物人源胰岛素Humulin、抑郁症药物Fluoxetine、精神领域药物Zyprexa,糖尿病代谢药物Tirzepatide,在不断研发突破中成为全球药企巨头,确立了公司在代谢、神经领域的领先地位。
2010年以来,公司在中国张江建立研发中心并发展全球业务。之后公司收购Siemens并扩充核药业务。2015年后,公司发力肿瘤与代谢赛道,收购LOXO获得重磅药物LOXO305,同时公司核心产品替尔泊肽启动关键III期减重临床试验,之后公司在代谢领域持续推进并取得突出成绩。同时,公司在神经领域的重磅药物Donanemab开启临床试验,产品有望于年内获批,为公司增加新动力;

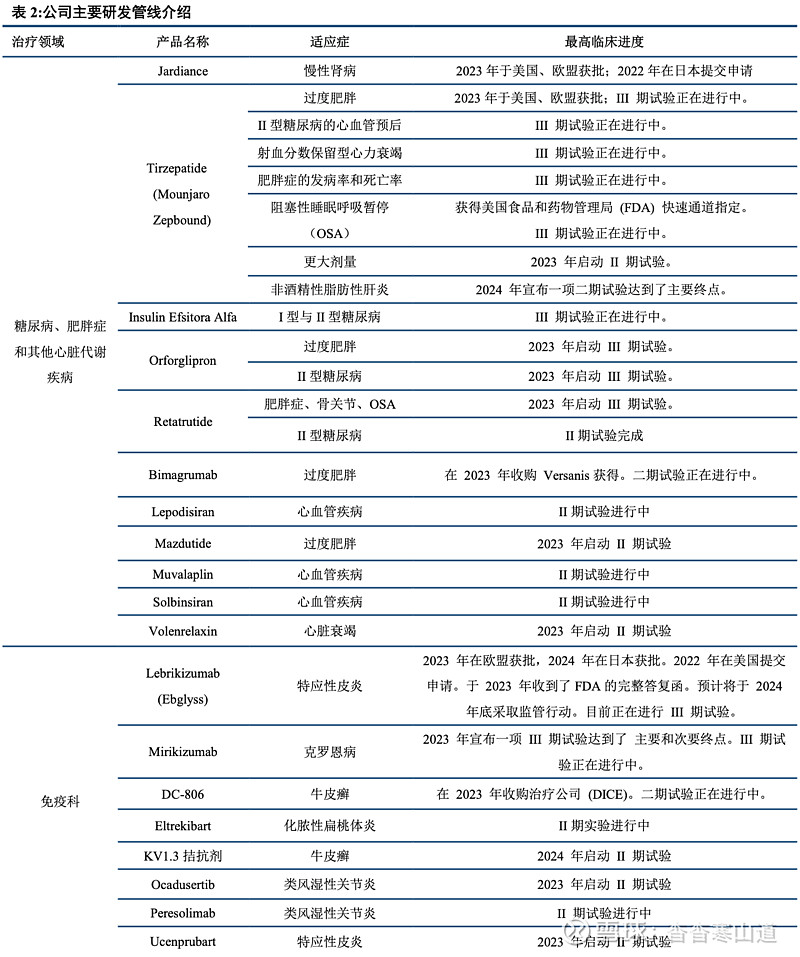
产品聚焦四大领域,管线储备丰富
主要布局四大领域,管线覆盖全面,后续储备丰富。公司主营创新药,核心业务聚焦代谢、肿瘤、免疫、神经科四大领域。代谢领域,Jardiance、Tirzepatide两款药物已分别于2014年、2022年在美国获批上市;免疫领域,Lebrikizumab已于日本、欧洲获批;神经领域,Donanemab于2023 年在美国、欧盟和日本申请批准并获得美国食品及药物管理局突破性疗法认定;肿瘤领域,Jaypirca于2023 年在美国获得FDA 加速批准。2023 年在欧盟获得批准并在日本提交申请,III 期试验正在进行中。其余多项药物正在进行II期、III期临床试验,后续管线储备丰富。除自研药物外,礼来公司通过并购、授权等多种方式提高管线覆盖程度。

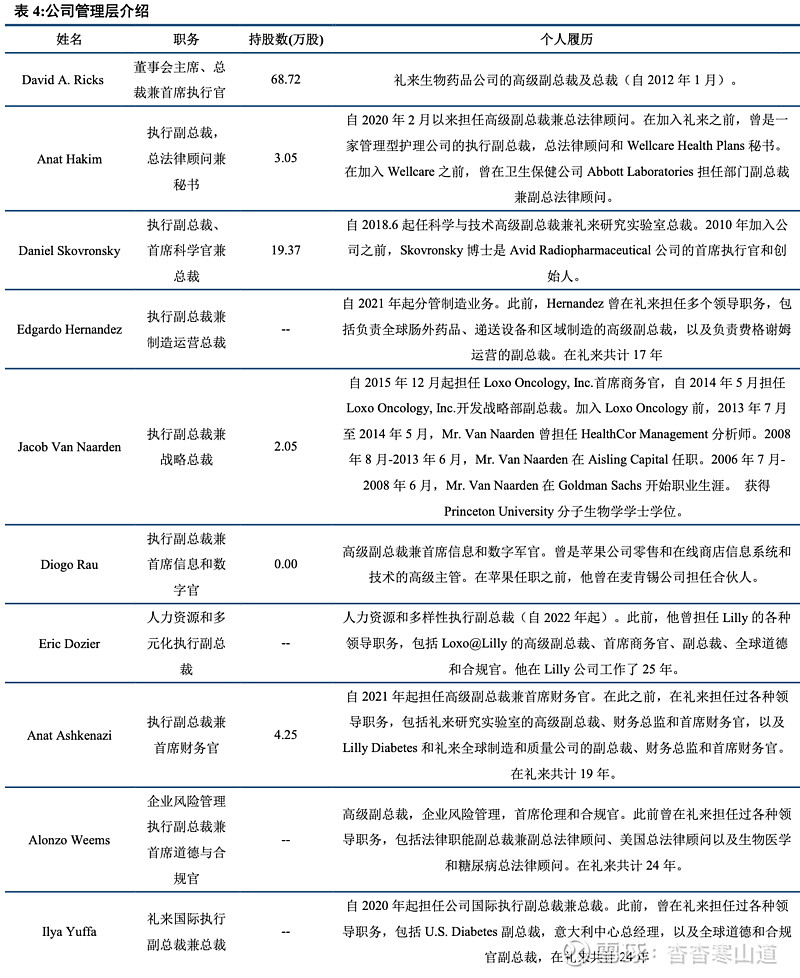
管理团队积淀深厚,多元人才助力高速发展
管理团队积淀深厚。公司董事会主席兼首席执行官David.A.Ricks先生在礼来共计工作20余年,兼任美国药物研发与制造协会、欧洲制药工业协会联合会董事会会员,在市场运营管理、医药领域有深厚功底与经验。公司法律顾问Anat Hakim曾在多家公司担任副总裁与法律顾问,积淀丰富;公司首席科学官Daniel Skovronsky曾是Avid Radiopharmaceutical公司的首席执行官和创始人,具有丰富的临床研究与药物研发经验。制造运营总裁Edgardo HernandezHernandez曾在礼来担任多个领导职务,包括负责全球肠外药品、递送设备和区域制造的高级副总裁,以及负责费格谢姆运营的副总裁,对礼来公司运营相关事宜经验丰富
“me-better”策略贯穿百年发展史,积极吸纳多元化人才。礼来坚持研发“更新,更好”的药物,基于已有药物存在的问题研发革新,招募大量研发专家,利用临床数据,解决实际临床需求。在“me-better”策略下,礼来公司坚持“每个阶段都只是阶段性胜利”的理念,不断丰富人才储备,向着下一个“更好”的目标迈进。2001年,公司创建“InnoCentive”在线科学论坛,并于该论坛张贴出困难的化学分子问题,悬赏全球的得以解决问题的顶尖科学专家,建立虚拟研发人才储备库;截至2023年,公司员工数量超过40000人,其中,研发人员超过12000人,遍及全球55个国家,并在9个国家设立研究中心。多元化的人才储备为公司做出“更新,更好”的药物奠定基础,助力实现高速发展;
营收增长强劲,新旧产品协同发力
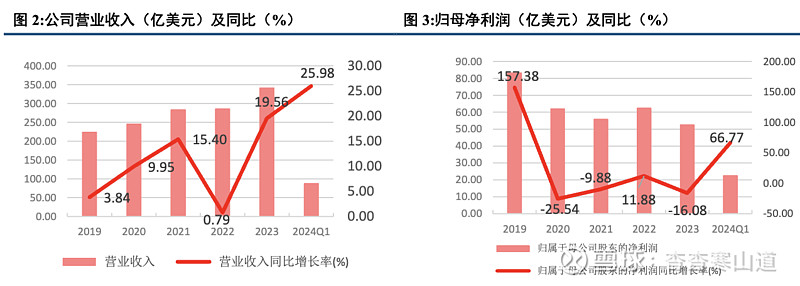
公司业绩稳中求进,营收增长强劲。2019年以来,公司营收增长稳步提速;在营收大基数的前提下,近五年仍保持10%的年复合增速;其中,2023年营收同比增长19.56%,实现营收341.24亿美元。公司归母净利润52.40亿美元,同比下降16.08%,主要因公司研发费用上升等原因。回顾公司近年业绩,我们认为:①公司核心产品头部地位稳固,量、价均双增。肿瘤、代谢等公司核心经营领域需求量持续走高,Mounjaro®, Verzenio®, Jardiance®三大核心产品维持高营收贡献度,并极有可能成为长期畅销药;②通过合作研发、并购、授权等途径,公司管线不断丰富,营收覆盖范围逐步拓宽。③公司多项前期研发进入收获期,GIP/GLP-1双靶点激动剂tirzepatide成功上市,donanemab达到临床试验所有目标。2024年一季度季报显示,礼来实现营收87.86亿美金,同比增长25.98%,公司上调2024年业绩预期。综上,我们期待礼来公司2024年核心产品持续放量,管线进一步丰富,业绩、营收迈向新台阶。
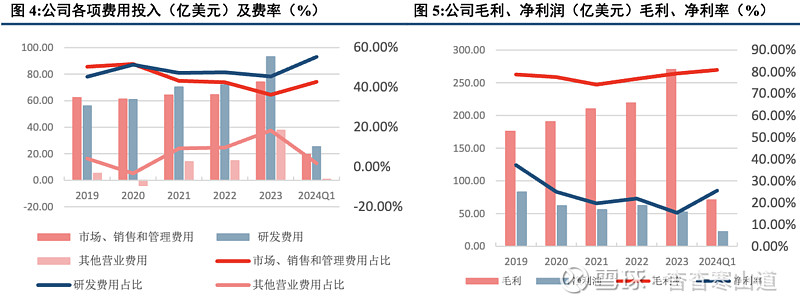
研发费用投入稳步提升,其余费用得到有效控制。近五年,公司研发费用投入稳步上升,2023年研发费用投入到达93.14亿美元,同比上升29.16%;研发费率稳定在50%左右。其余费用控制良好,结构稳定。公司维持接近80%的毛利率,2023年毛利率达到79.24%,实现毛利润270.42亿美元,同比上升23.41%;实现净利率15.37%,同比下跌16.09%。2024年一季度,毛利率提升至80.91%,净利率25.58%,实现强劲增长。我们认为公司研发费用持续走高,符合公司经营情况;各项费用得到有效控制,结构合理。2024第一季度,礼来归母净利润实现强劲增长,同比增长66.77%,我们看好礼来2024公司业绩迈向新台阶
公司业务结构明确,核心业务、新产品协同发力。追踪公司近五年来分业务营收,公司核心领域明确,集中于代谢类、神经类、肿瘤类、免疫类四大板块。其中,除免疫类药物因新冠试剂销售额下降外,其余三大领域均实现连年增长,糖尿病、精神科药物营收增长势头强劲。2023年,公司代谢类药物实现营收217.38亿美元,占主营业务收入59%,同比增长31.68%,其中,糖尿病药物营收由2019年9.44亿元跃升至2023年27.45亿元,有望成为公司药物持续核心增长点;肿瘤类药物实现营收56.52亿美元,同比增长14.20%;神经类药物实现营收23.73亿美元,同比增长86.70%。此外,公司授权、收购药物使管线覆盖面逐步提升,营收增长可观。我们认为,公司核心领域聚焦明确,老牌产品与新产品协同发力共同带来营收增长;收入结构合理,未来增长可观。

礼来与诺和诺德齐头并进,在GLP-1赛道持续前进
GLP-1领域,礼来与诺和诺德齐头并进,均布局多款药物。整体看,在GLP-1皮下注射制剂端,礼来在GLP-1领域的布局思路为多靶点机制药物,靶点涉及GCG和GIP,而诺和诺德则在GLP-1领域探索GLP-1类药物与Amylin类药物的联合应用潜力。在口服制剂端,礼来重点探索小分子口服类药物的应用潜力,而诺和诺德则基于优异的SNAC技术将肽类药物应用在口服剂型上。整体看,两家公司在GLP-1领域的布局均十分深厚,产品管线矩阵丰富,在靶点探索上也具备超前性,竞争力均十分强劲;
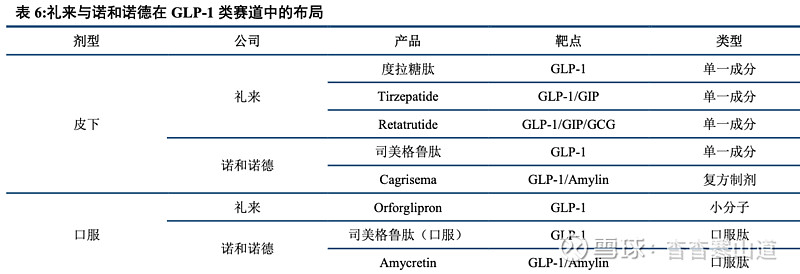
礼来在GLP-1领域持续深耕,2024年催化剂众多,商业化有望持续迎来增长。在GLP-1领域,礼来的布局多款类型产品,涵盖皮下给药以及口服剂型。整体看,公司GLP-1领域2024年催化剂众多,同时核心产品Tirzepatide有望持续迎来高速放量,实现销售额超100亿美金。整体看,礼来未来在GLP-1的催化剂主要来自于:①在肥胖和糖尿病人群中的渗透率持续提升。②在其他适应症中的渗透率逐步提升,如MASH、HFpEF、心脑血管患者人群。③在商业保险中的准入率持续提升,潜在进入美国CMS医保覆盖后的渗透率提升

Tirzepatide(Mounjaro):双靶降糖药开启糖尿病患者用药新时代
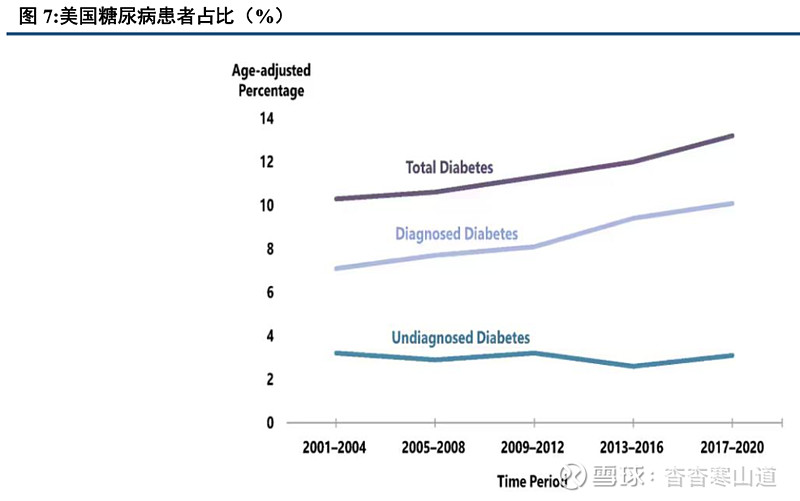
糖尿病是一种复杂的慢性代谢性疾病,影响全球5亿以上成年人群。根据IDF的报道,全球有5.37亿成年人患有糖尿病,约等于每十个人中就有一个人患病。同时,糖尿病患者群体依然处于持续增加状态,预计在2045年将增长至7.83亿人。同时,糖尿病作为一种复杂的慢性代谢疾病,会导致患者出现肾病、视网膜病变、下肢动脉病变等问题,严重还可危及生命;
糖尿病中2型糖尿病类型患者占比达90%,美国现有患者超3000万。根据NIH的数据,2型糖尿病是一种以胰岛素抵抗为主要特点的疾病,患者由于胰岛素分泌不足以及细胞失去对胰岛素正常的感应能力,导致吸收糖分减少从而导致血液内糖分浓度超过标准并引起糖尿病。根据CDC报道,美国现有2型糖尿病患者人数已经超过3000万,约占美国全部人口的10%;
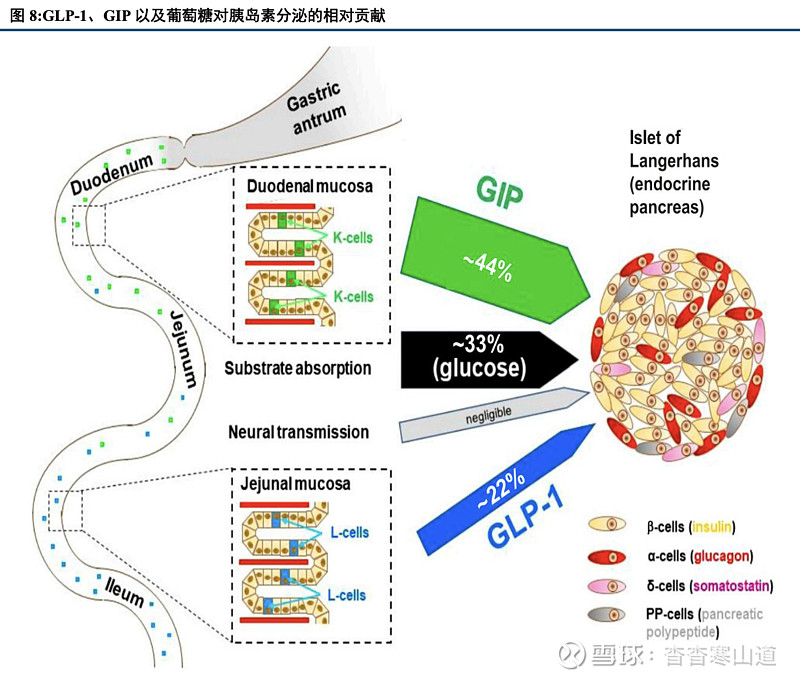
GLP-1与GIP均为人体内天然激素,在血糖调节中起到重要作用,可有效治疗2型糖尿病。GLP-1(Glucagon-Likepeptide-1,胰高糖素样肽-1)是一种由肠道L细胞分泌的天然激素,体内半衰期约为1-2分钟。人体内的GLP-1在分泌后会有GLP-1R(GLP-1受体)结合并激动GLP-1R,从而以葡萄糖浓度依赖性的方式增强胰岛素分泌并调节血糖,除此之外,GLP-1还潜在具备延迟胃排空、减重、降脂等潜在作用。同样,GIP(Gastric inhibitory polypeptide,抑胃肽)同样由人体的K细胞自分泌产生,在体内半衰期为4-7分钟。GIP在人体内具有促进胰岛素分泌并改善敏感性、增加GLP-1分泌和促进胰岛细胞增殖等多种作用,可与GLP-1一起协同调节人体血糖平衡,起到控糖效果
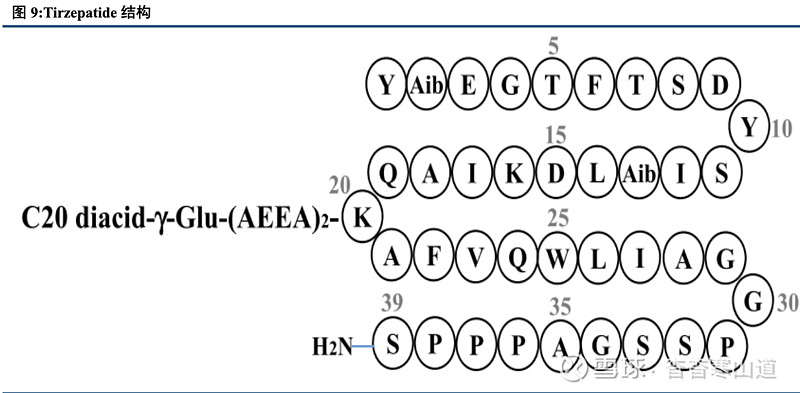
Tirzepatide可同时激活GLP-1R和GIPR,有望带来潜在更佳的降糖效果。Tirzepatide是由39个氨基酸组成的多肽药物,可同时激活GLP-1R和GIPR。同时,在C20脂肪酸侧链的修饰下,Tirzepatide在人体内半衰期可达到约5天,所以可作为周制剂给药,大大提高患者用药依从性。在体内,Tirzepatide可有效同时激活GLP-1受体以及GIP受体,双重激动下产生强而稳定的降糖效果;
Tirzepatide已开展多个III期糖尿病适应症临床试验,针对不同类型的糖尿病患者进行研究探索。Tirzepatide针对不同类型的糖尿病患者开展临床试验,6项关键临床试验覆盖的人群超千人


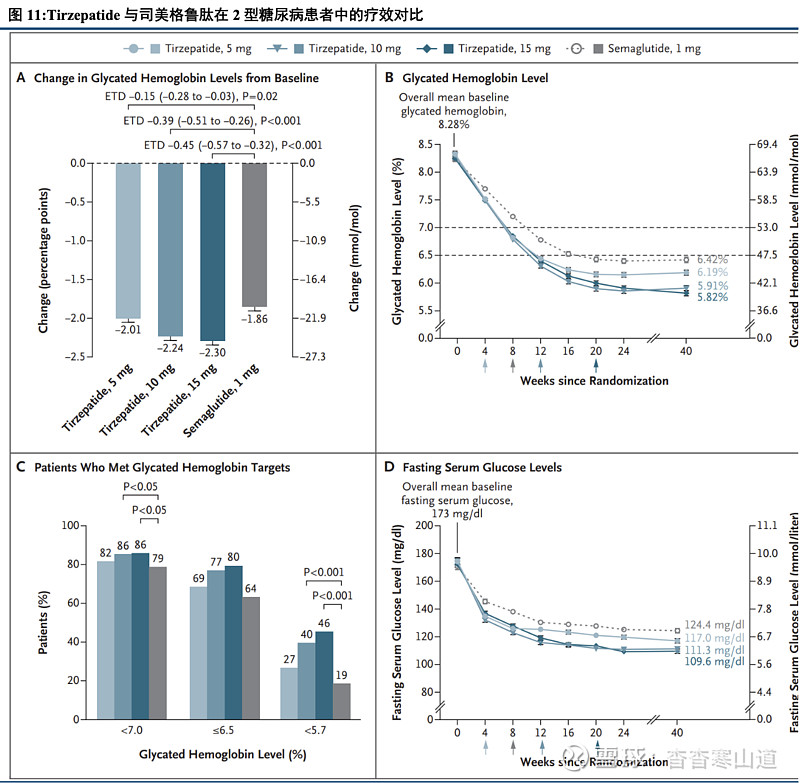
降糖效果显著优于司美格鲁肽,Tirzepatide有望为糖尿病患者提供更佳的用药选择。在编号为SURPASS-2的临床试验中,共计纳入1879名患者,按1:1:1:1分配至Tirzepatide 5mg组、Tirzepatide 10mg组、Tirzepatide 15mg组以及司美格鲁肽1mg组。主要终点为给药40周后患者的糖化血红蛋白(HbA1c)变化值。在给药40周后,Tirzepatide 5mg组、Tirzepatide 10mg组、Tirzepatide 15mg组以及司美格鲁肽1mg组的HbA1c变化值为:-2.01%、-2.24%、-2.30%和-1.86%。同时,Tirzepatide三个剂量组的患者HbA1c下降程度均显著优效于司美格鲁肽组。我们认为,这一结果证明Tirzepatide在糖尿病患者中拥有比司美格鲁肽更好的控糖效果,患者可实现更佳的血糖控制;
Tirzepatide向多个适应症进行拓展,有望为2型糖尿病患者提供个体化保护。根据ADA指南,2型糖尿病的治疗已逐步发展到患者个体情况给药。Tirzepatide目前开展多个2型糖尿病兼其他适应症患者的临床试验,后续有望在多个适应症中展现优异疗效,值得期待
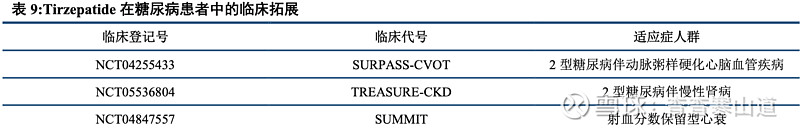
Tirzepatide糖尿病适应症产品Mounjaro自2022年5月在美国上市后销售表现出色,2023年全年销售额51.63亿美金。Tirzepatide于2022年5月在美国获批上市,用于治疗2型糖尿病患者。产品上市后在2022年二季度实现0.16亿美金,之后因Tirzepatide在糖尿病患者中有良好的降糖疗效,产品上市后销售表现出色,并且于2023年全年实现51.63亿美金的销售额,同比增长971.16%。
Tirzepatide(Zepbound):重磅双靶点减重药,有望造福全球肥胖患者
超重和肥胖是许多慢性病的主要风险因素,需要进行有效控制。根据世界卫生组织的定义,超重和肥胖被定义为对健康构成风险的异常或过多脂肪堆积。体重指数(BMI)超过25被视为超重,超过30则为肥胖。同时根据“美国临床内分泌医师学会”的报告,由于肥胖症率在过去30年的飞速成长,已成为全球共同面临的重大公共卫生危机。根据《中国居民肥胖防治专家共识》,心血管疾病、糖尿病、部分癌症等慢性非传染性疾病(以下简称“慢性病”)导致的死亡人数占中国居民总死亡人数的近90%,而超重和肥胖是慢性病的主要危险因素,所以对于超重与肥胖的重视刻不容缓。
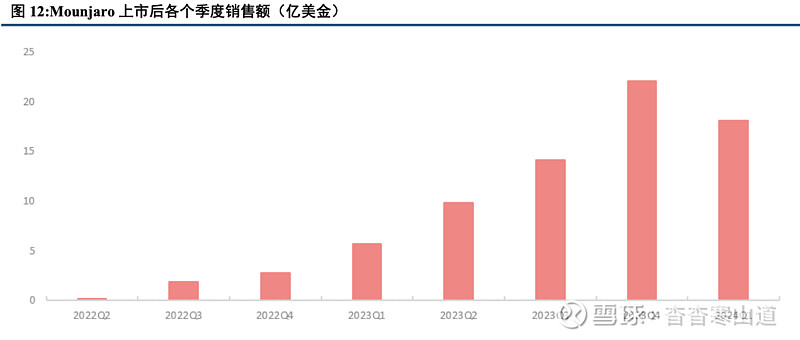
全球超重与肥胖人群数量持续提升,2030年成年人口中超重或肥胖人群将达到29亿人,占全球成年人口的一半。根据WHO,自1990年以来,全球成人肥胖增加了一倍多,青少年肥胖增加了三倍,目前超重及肥胖人口已超过20亿。根据《世界肥胖报告》,全球超重及肥胖成年人群将在2025年达到25.3亿人,在2030年达到29亿人,在2035年达到33亿人。随着超重与肥胖的人口逐步增加,对全球经济产生的影响也是显著的,如果不采取措施,预计到2030年,全球超重和肥胖的成本将达到每年3万亿美元,到2060年将超过18万亿美元
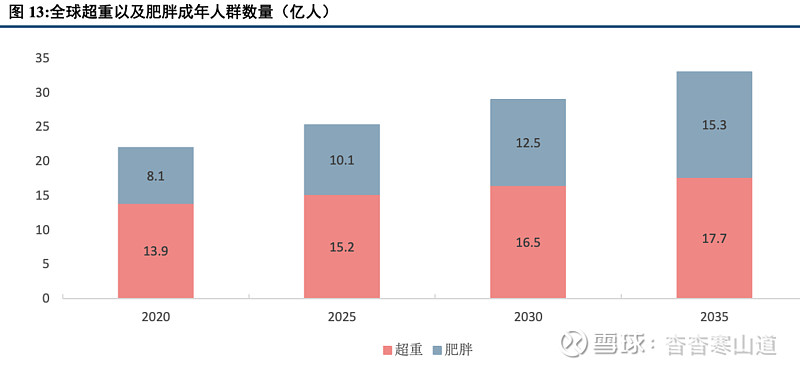
美国2020年肥胖率已超40%,所有州和地区的肥胖率均高于20%。根据CDC公告,美国2017-2020年的肥胖人群占比已经超过40%,同时所有州和地区的肥胖率均高于20%。整体来看,美国肥胖率已经处于高水平,部分肥胖患者需要进行一定有效的干预措施来保证身体健康
Tirzepatide 72周可使超重或肥胖人群体重下降22.5%,显著优于安慰剂组。在SURMOUNT-1临床试验中,Tirzepatide 15mg组在给药后可让超重或肥胖人群体重下降22.5%,显著优于安慰剂组的-2.4%。同时,Tirzepatide 5mg、10mg以及15mg组的患者的体重下降比例超过5%的人群分别为89%、96%和96%,均优于安慰剂组的28%。本临床试验证明Tirzepatide可显著有效降低患者体重,让超重或肥胖患者达到目标体重。
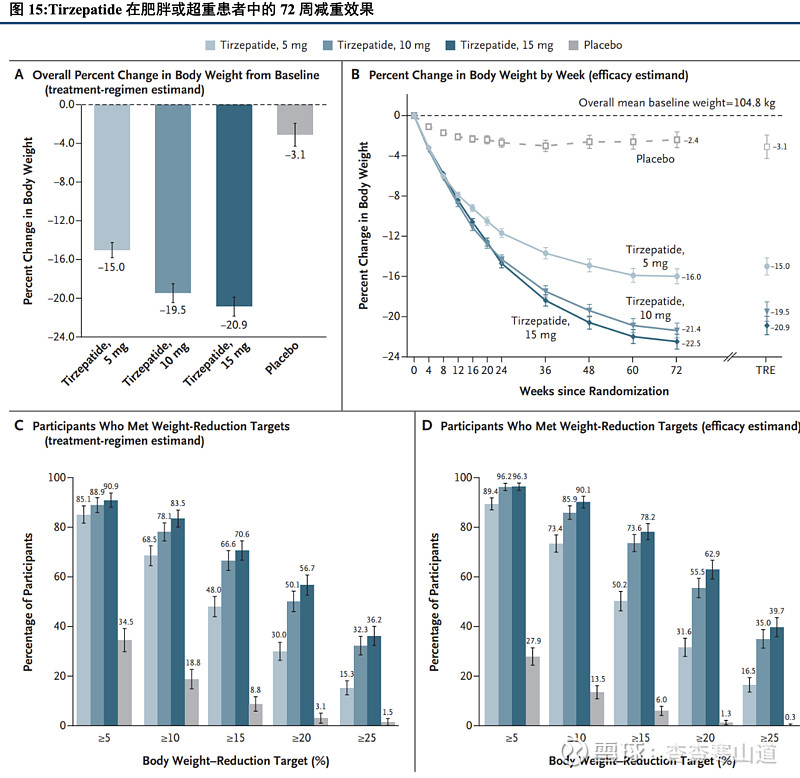
减重适应症已于2023年11月美国获批上市,产品后续放量值得期待。2023年11月,美国食品药品管理局(FDA)批准Tirzepatide用于治疗超重或肥胖人群。根据CDC的相关数据,目前美国超70%的人群受到超重或肥胖的困扰。我们认为,Tirzepatide可有效降低患者体重,为超重或肥胖人群提供新用药选择,产品后续放量可期。
Tirzepatide向多个适应症拓展,持续扩大产品适应症范围。除糖尿病以及减肥适应症外,Tirzepatide还向MASH(代谢功能障碍相关脂肪性肝炎)、CKD(慢性肾病)和OSA(睡眠呼吸暂停综合征)等疾病拓展。随着Tirzepatide有望或已经在适应症上迎来突破,未来产品的覆盖人群将有望迎来进一步扩大,同时在肥胖或糖尿病伴并发症患者中的渗透率有望得到进一步提升。

Tirzepatide在MASH适应症中展现出色疗效,达到双终点。在MASH Resolution终点上:在52周时,安慰剂、5mg、10mg和15mg替尔泊肽的MASH Resolution改善率为9.8%、43.6%、55.5%和62.4%。所有给药组相较于安慰剂组均达到显著改善(P<0.001)。在Fibrosis Improment:在52周时,安慰剂、5mg、10mg和15mg替尔泊肽的Fibrosis Improment改善率为29.7%、54.9%、51.3%和51.0%。所有给药组相较于安慰剂组均达到显著改善(P<0.05)。整体看,替尔泊肽除了在Fibrosis Improment终点上没有体现出明显的量效关系外,产品的两个终点数据均达到显著改善,疗效优异。
Retatrutide:创新型三靶点药物,有望带来更强减重效果
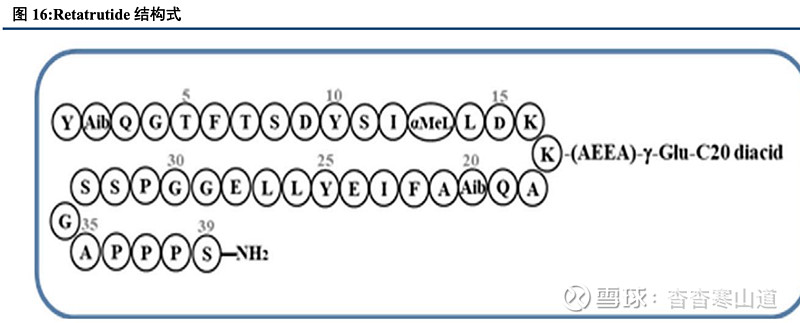
创新型三重激动剂,可有效改善血糖以及高体重。Retatrutide是礼来研究发明的一款创新性三靶点激动剂,设计方式上,礼来在GLP/GIP双受体激动剂替尔泊肽基础上通过杂合胰高血糖素(GCG) 相关结构来实现三重激动效果,可有效改善血糖以及高体重问题
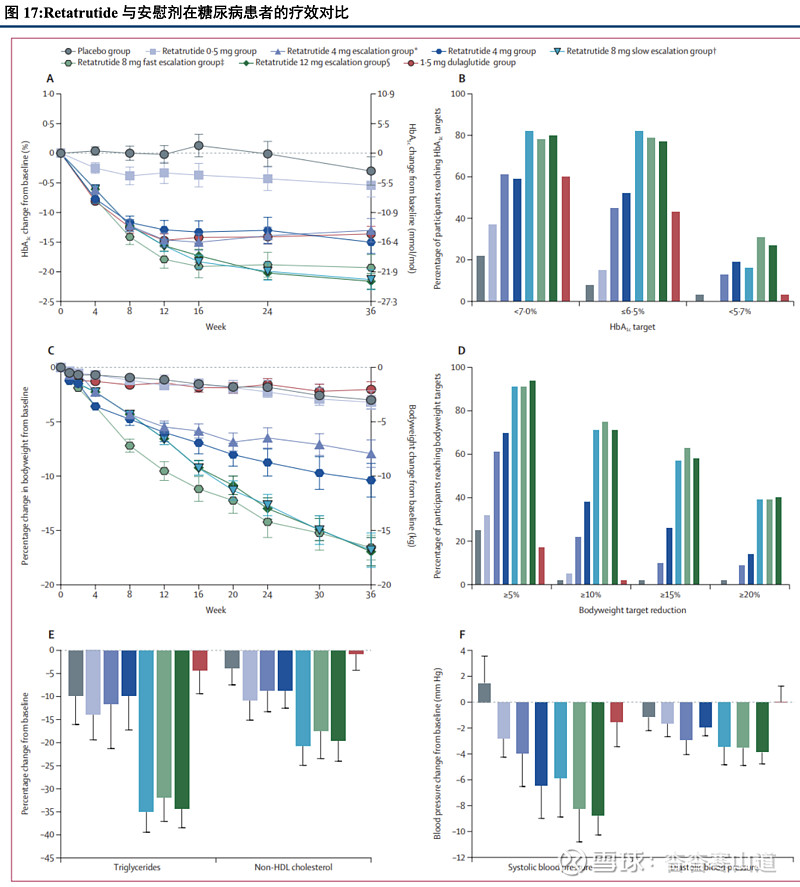
Retatrutide多个剂量组均可有效降低患者血糖。在一项2期临床试验中,Retatrutide 4、8和12mg剂量组均可有效降低患者血糖,降糖效果最好的12mg组在给药24周后患者HbA1c下降为2.02%,显著优于安慰剂组的0.01%。
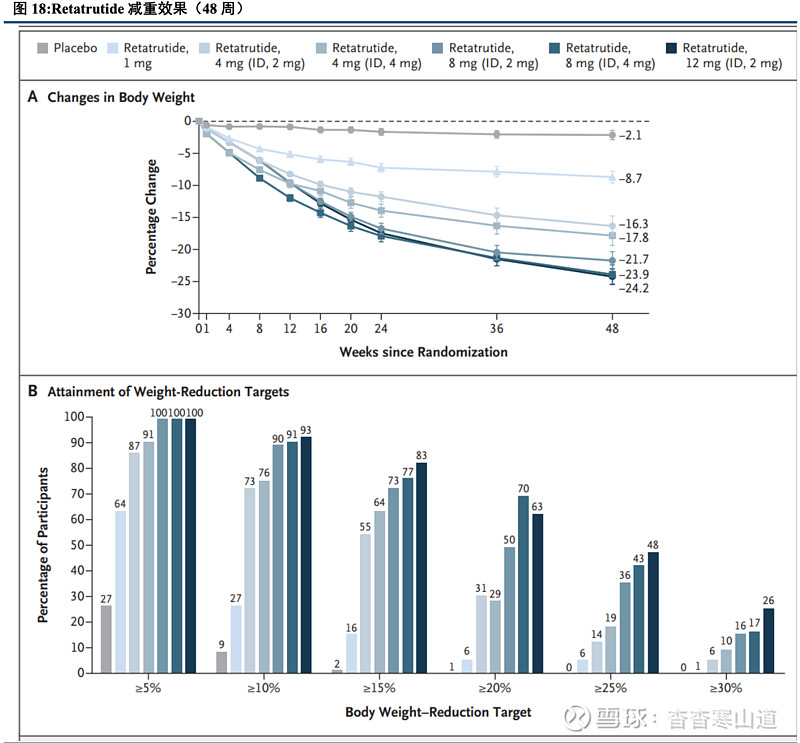
Retatrutide降体重效果显著,可让肥胖患者用药后48周体重下降超24%。Retatrutide在超重或肥胖患者汇总展现出显著的降体重效果,在一项2期临床试验中,共计入组338名超重或肥胖患者,分别使用Retatrutide 1mg、4mg、8mg、12mg和安慰剂组作为给药,在给药48周后,患者体重下降比例分别为-8.7%、-17.1%、-22.8%、-24.2%和-2.1%。非横向对比来看,Retatrutide 12mg组给药后48周的数据优于Tirzepatide 15mg组72周的数据。
持续推进,Retatrutide开展多项关键三期临床试验。Retatrutide在早期研究中展现出了优异的降糖以及减重效果,目前公司已经就Retatrutide开展多个关键三期临床试验,为公司未来营收的持续增长来提供动力与保证。

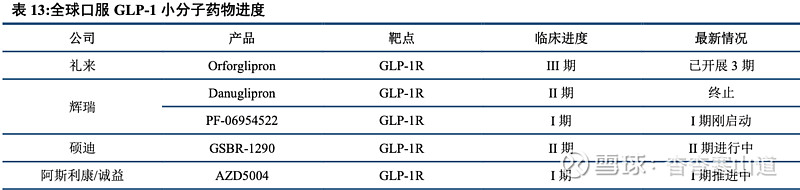
Orforglipron:全球进度领先的口服GLP-1R小分子,有望带来新用药选择
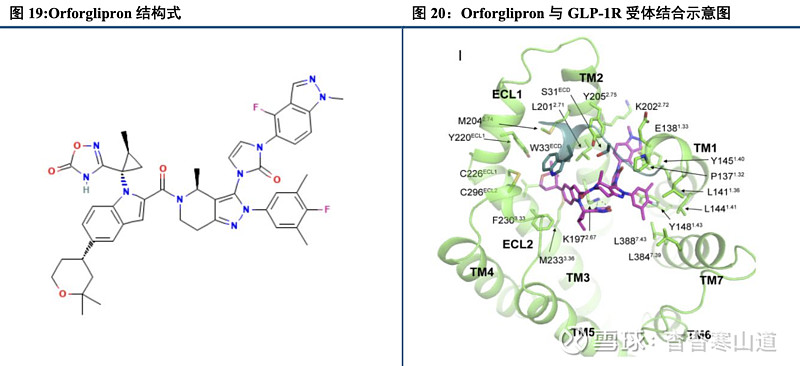
创新型口服小分子药物,Orforglipron可有效结合GLP-1受体。目前主流GLP-1类药物为皮下注射药物,而已上市口服类药物暂无口服小分子类。Orforglipron为礼来与Chugai合作的一款口服类小分子GLP-1R药物。相较于此前的苯丙氨酸衍生物、喹喔啉和嘧啶类药物,Orforglipron具备更好的结合效力以及更好的药动学特征。Orforglipron在体外研究中被证明相较于天然GLP-1可显著刺激GLP-1R诱导的cAMP累积,从而具备潜在的降糖以及减重效果。
Orforglipron可与GLP-1R受体的多个区域位置结合,产生激动效果。Orforglipron可与GLP-1受体的细胞外域以及跨膜部分结合,与天然GLP-1不同,Orforglipron主要与GLP-1R的ECD(N-terminal extracellulardomain)、TM1(Transmembrane)、TM2、TM3、ECL2和TM7,而GLP-1则与除TM4外的所有结构域强结合。这一特殊结合带来潜在更佳的腺苷酸环化酶激活效果并带来后续生理化作用。
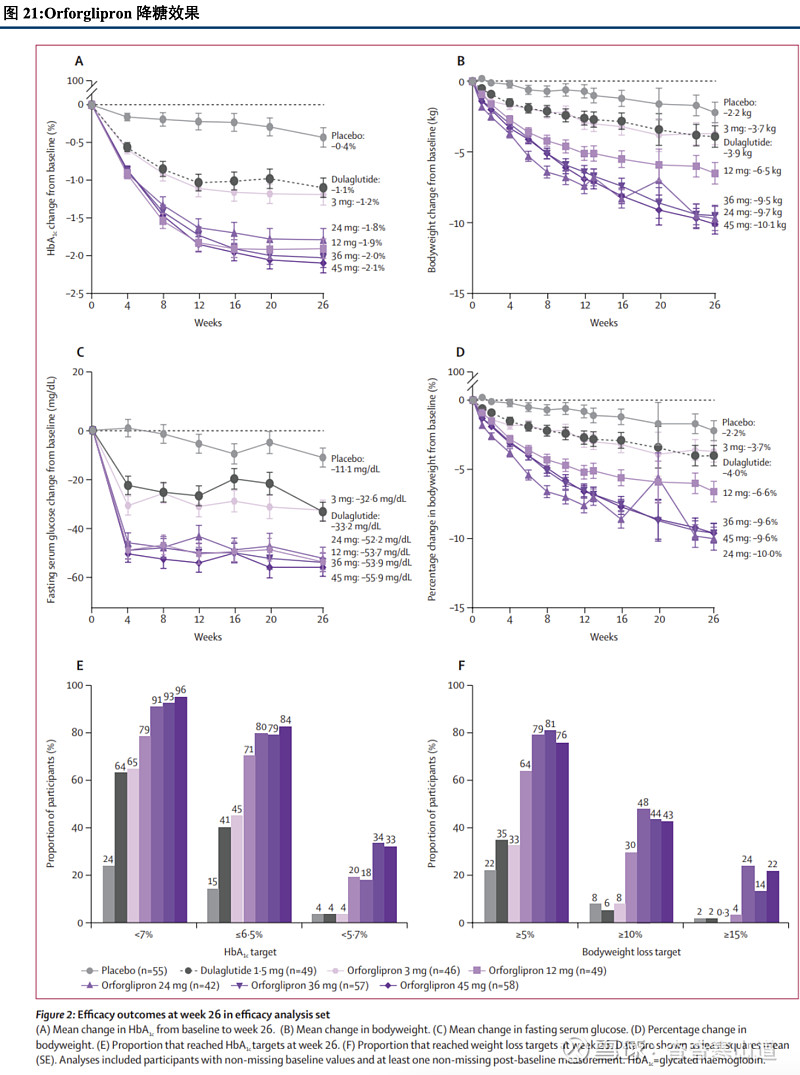
降糖效果强于度拉糖肽,Orforglipron 2期糖尿病临床试验数据出色。在编号为NCT05048719的2期临床试验研究中,Orforglipron展现出色的降糖效果,在给药26周后,Orforglipron组、度拉糖肽组以及安慰剂组的HbA1c下降幅度分别为-2.10%、-1.10%和-0.43%。同时,Orforglipron与度拉糖肽组的受试者均无一人因副作用退出临床试验,整体安全性良好。
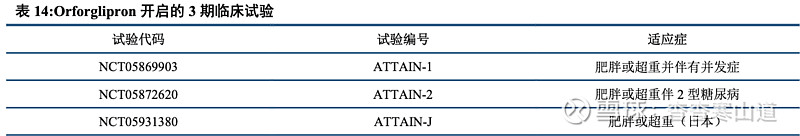
Orforglipron开启多项糖尿病III期临床试验,后续结果可期。Orforglipron目前已开展多个重要三期临床试验,涵盖糖尿病患者用药中的多种情形。随着试验的持续推进,Orforglipron在未来有望帮助多种情况下的2型糖尿病患者,同时也有望展现降低心脑血管风险的附加作用。

减重效果出色,非横向对比可达到皮下注射制剂效果。除降糖外,Orforglipron还具备减重效果。在一项编号为NCT05051579的2期临床试验中,Orforglipron展现出了出色的减重效果。高剂量45mg组以及安慰剂组在给药26周后的体重下降比例分别为12.6%和2.0%,安慰剂校正后的下降比例为10.6%。非横向对比,周制剂司美格鲁肽在给药68周后安慰剂矫正后的体重下降比例为10.3%,Orforglipron减重效果好于司美格鲁肽。作为口服制剂,Orforglipron具备出色的减重效果以及更为方便的给药方式,未来商业化可期。
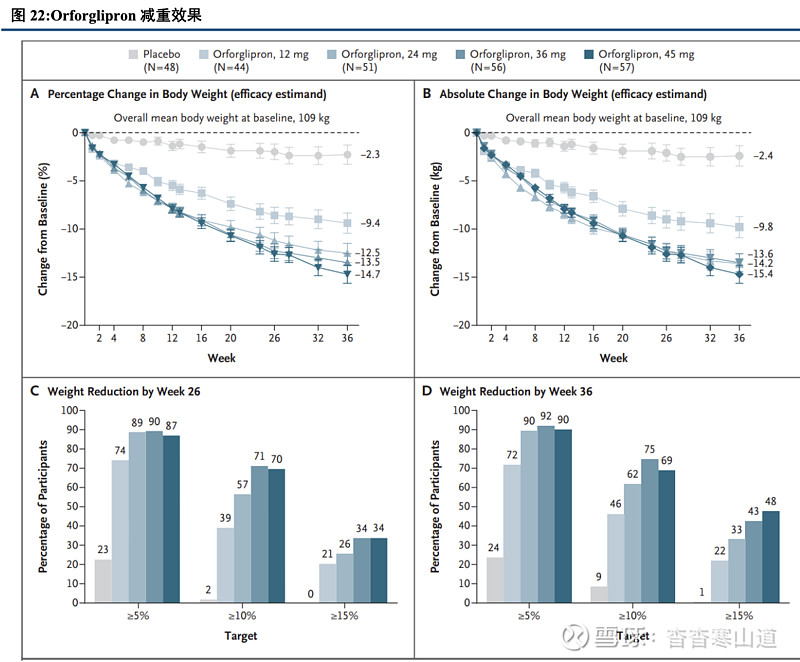
多个三期临床启动,Orforglipron有望成为首个商业化的减重口服GLP-1R小分子药物。目前Orforglipron已开展3个减重3期临床试验,随着产品的临床进度持续推进,未来Orforglipron有望成为首个商业化的口服GLP-1R小分子药物。