
原载《医讯信通》
根据IMS数据,2017年中国低分量子肝素市场接近60亿元,每年以10%的速度增长,
2011年CFDA药品评审中心发表文章《关于低分子量肝素类药品的审评思考 》,文中明确提出“建议企业对照EP那曲肝素钙、达肝素钠和依诺肝素钠的要求以及国外已上市原研发厂产品,根据不同工艺、末端结构、分子量及其分布、抗Ⅹa因子活性、抗Ⅱa因子活性、抗Ⅹa因子与抗Ⅱa因子活性比对LMWH进行分类研究与完善,然后按照相应的注册分类进行申报。同时也建议对国内已上市的LMWH及制剂在一定的时间内根据其工艺等进行细分与质量标准的提高工作。” 意思是:之前仿制研究没做好、技术不过关、质量标准达不到的药,属于应当被淘汰的药,面临的命运是被动提高质量标准或被市场淘汰,低分子肝素钙/钠批文将在2021年到期。
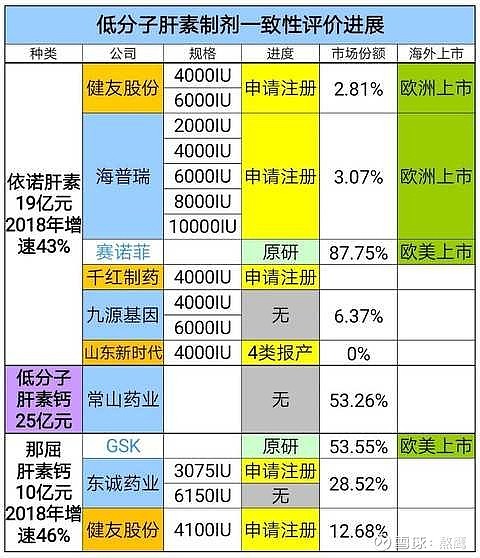
搬球友的表,不够准确,意到!
全部讨论
2019.3公示第21批参比制剂,Sanofi五个规格。
国内生产企业较多且竞争激烈,市场较为分散,其中未分类低分子肝素占比 50%左右
2013 年 11 月,药品审评中心发布《关于仿制的低分子肝素类产品新增技术要求的意见》,该《意见》明确指出,根据 FDA 于 2011 年 10 月发布的《依诺肝素钠生物等效性指南草案》,药品审评中心对国内低分子肝素类产品仿制的技术要求进行了研讨,要求国内企业申报的低分子肝素类仿制产品除按照此前要求进行相关研究外,还应新增人体药效学等效研究,以保证与被仿产品的质量一致性,即对国内低分子肝素制剂仿制药首次提出了“五个一致性”要求,具体包括:“肝素原料来源和解聚方式等同”、“理化性质等同”、“二糖结构单元、片段图和低聚糖类序列等同”、“生物学和生化检测等同”、“人体药效学等效研究”。
13年以后发的老六类批件有没有执行?包括双鹭?
2011 年 10 月,美国 FDA 发布了《依诺肝素钠指南草案》(《Draft Guidance on Enoxaparin Sodium》),对依诺肝素仿制药提出了更为明确的技术要求,包括:
1、理化性质等同;
2、肝素原料来源和解聚方式等同;
3、二糖结构单元、片段图和低聚糖类序列等同;
4、生物学和生化检测等同;
5、人体药效学等效研究(人体内药效学特征:抗因子 Xa、抗因子 IIa 活性),
即五个一致性要求,对进入美国市场的低分子肝素制剂仿制药标准提出了更高要求。
低分子肝素钙批文明年到期,届时3O亿的市场将让岀来,结合目前国内一致性评价只有海普瑞一家通过,无疑将是最大的受益者。目前海普瑞在欧盟市场正迅速替代原研,整体市场占有率将达到惊人的45%!国内受惠于政策改变海普瑞在未来几年也将迅速替代原研,市场占有率将大幅度提高。




