
近日,恒瑞医药创新药卡瑞利珠单抗(艾瑞卡®)联合阿帕替尼(艾坦®)(“双艾”组合)和化疗一线治疗晚期胃癌的Ⅰ期研究(SPACE研究)成果全文发表于《自然》子刊、国际知名医学期刊《Signal Transduction and Targeted Therapy》1(STTT,IF=39.3)。该研究由江苏省人民医院(南京医科大学第一附属医院)束永前教授/陈晓锋教授团队开展,是首个评估卡瑞利珠单抗(PD-1抑制剂)联合阿帕替尼(抗血管生成药物)和化疗一线治疗晚期胃癌的研究,实现了靶免化一线治疗晚期胃癌的新突破,有望为晚期胃癌一线治疗带来新思路。

研究背景
胃癌是全球第五大最常见的恶性肿瘤,也是导致癌症相关死亡的第四大原因2。我国是胃癌高发国家,2020年我国最新数据显示胃癌发病率和死亡率在各种恶性肿瘤中均位居第三位3。许多胃癌患者诊断即为晚期,既往晚期胃癌一线治疗标准方案为铂类或氟嘧啶类为基础的化疗4。随着肿瘤治疗进入免疫时代,PD-1单抗联合化疗已成为晚期胃癌一线标准治疗方案,如何进一步联合增效提高晚期胃癌的生存率,正在成为新的探索方向。
抗血管生成抑制剂可以通过使血管系统正常化并将TME(肿瘤微环境)重新校准到刺激免疫反应的状态来逆转这些作用,从而增强抗PD1/PD-L1抗体的疗效5-6。因此,将抗血管生成抑制剂与PD1/PD-L1抗体联合是一种有前景的癌症治疗方法,并且有几种此类组合已被批准为不同类型癌症的标准治疗方法,如不可切除肝细胞癌(HCC)、晚期肾细胞癌和晚期非鳞状非小细胞肺癌(NSCLC)7-8。
阿帕替尼是一种新型的小分子酪氨酸激酶抑制剂,选择性靶向血管内皮生长因子受体2(VEGFR2),从而抑制肿瘤的血管生成9。基于II期和III期临床试验结果,阿帕替尼可显著改善患者生存,在中国被批准用于晚期胃癌的三线或后线治疗10。阿帕替尼联合卡瑞利珠单抗在晚期NSCLC、HCC和晚期食管鳞状细胞癌患者中均显示出令人鼓舞的结果11-13。阿帕替尼联合卡瑞利珠单抗已在中国获批用于晚期HCC14。此外,一项II期临床试验显示,卡瑞利珠单抗联合CAPOX(卡培他滨联合奥沙利铂)一线治疗晚期胃癌,序贯卡瑞利珠单抗联合阿帕替尼,显示出良好的抗肿瘤疗效和可耐受的安全性15。
基于以上证据,束永前教授/陈晓锋教授团队开展了一项卡瑞利珠单抗联合阿帕替尼和化疗一线治疗晚期胃癌的剂量递增和扩展I期临床研究,旨在确定卡瑞利珠单抗联合阿帕替尼和化疗的最佳给药剂量、耐受性和抗肿瘤活性。
研究方法
本研究是一项单臂、多中心、开放标签的剂量递增(1a期)和剂量扩展(1b期)的Ⅰ期研究,旨在确定卡瑞利珠单抗联合阿帕替尼和化疗的一线治疗晚期胃癌的疗效和安全性。主要入组标准:年龄18-75岁,组织学或细胞学确诊胃或胃食管结合部腺癌,HER2阴性或未知,临床分期为IV期,包括晚期转移性胃癌(cTanyNanyM1)和不可切除的局部晚期胃癌(cT4bNanyM0),根据RECISTv1.1标准有至少一处可测量病灶,ECOG PS 0-1,预期生存期≥3个月,足够的器官功能。
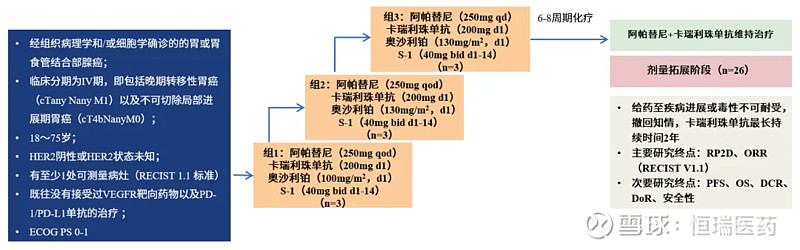
图1. SPACE研究设计
在1a阶段,采用传统3+3剂量递增设计确定最大耐受剂量(MTD)。包括3个剂量组,每个剂量水平依次入组3例患者。剂量组1:阿帕替尼,250mg,po(口服),qod(隔日一次)+卡瑞利珠单抗,200mg,i.v(静脉注射),d1(第1天)+奥沙利铂,100mg/m2,d1,i.v+替吉奥,40mg,po,bid,d1-14;剂量组2:阿帕替尼,250mg,po,qod+卡瑞利珠单抗,200mg,i.v,d1+奥沙利铂,130mg/m2,d1,i.v+替吉奥,40mg,po,bid,d1-14;剂量组3:阿帕替尼,250mg,po,qd+卡瑞利珠单抗,200mg,i.v,d1+奥沙利铂,130mg/m2,d1,i.v+替吉奥,40mg,po,bid,d1-14。治疗直至不可耐受毒性、疾病进展或死亡。
如果在每个剂量水平治疗前21天内≤1例患者经历DLT,则该剂量水平升级到随后的更高水平;如果在给定剂量水平下有≥2例患者经历DLT,则停止剂量递增,并将先前的剂量水平视为MTD。DLT定义为在治疗前21天内出现任何4级血液学不良事件或任何≥3级非血液学不良事件,或因卡瑞利珠单抗或阿帕替尼任何不良事件导致给药延迟21天或更长时间。通过1a期所有安全性和有效性数据来确定Ⅱ期剂量(RP2Ds)。在1b期给予RP2Ds,每3周一次,直到疾病进展或不可耐受毒性、撤回同意,或达到8个化疗周期及卡瑞利珠单抗和阿帕替尼持续给药2年。
主要研究终点为1a期最大耐受剂量(MTD)、1a和1b期确认的客观缓解率(ORR),次要研究终点为无进展生存时间(PFS)、总生存期(OS)、疾病控制率(DCR)、缓解持续时间(DoR),探索性终点为与抗肿瘤活性相关的生物标志物分析。
研究结果
2020年6月12日至2022年10月6日,研究共纳入34例胃癌/胃食管交界处癌(GC/GEJC)患者(1a期9例,1b期25例)。1a期未发生剂量限制性毒性,未发现MTD,最终确定剂量水平3:阿帕替尼,250mg,po,qd、卡瑞利珠单抗,200mg,i.v,d1、奥沙利铂,130mg/m2 ,i.v,d1、替吉奥40mg,po,bid,d1-14作为Ⅱ期推荐剂量(RP2D)。
在接受治疗的34例患者中,确认的ORR为76.5%(95% Cl:58.8-89.3),疾病控制率(DCR)达到91.2%(76.3-98.1),中位缓解持续时间(DoR)延长7.6个月(5.4-NE)。PD-L1 CPS
中位随访时间11.9个月(IQR,8.0-23.0),中位无进展生存期(PFS)为8.4个月(95%CI:5.9-NE)。中位OS不成熟(95%CI:11.6-NE)。1年和2年的OS率分别达到69.1%(95%CI:49.9-82.2)和62.8%(41.3-78.3)。中位无事件生存期(EFS)为22.3个月(95%CI:7.1-NE)。10例患者治疗后,在多学科团队评估后接受手术治疗,与未手术患者相比,手术患者的EFS和OS更优(中位EFS:23.1vs.8.4个月;中位OS:未达到vs.19.6个月)。
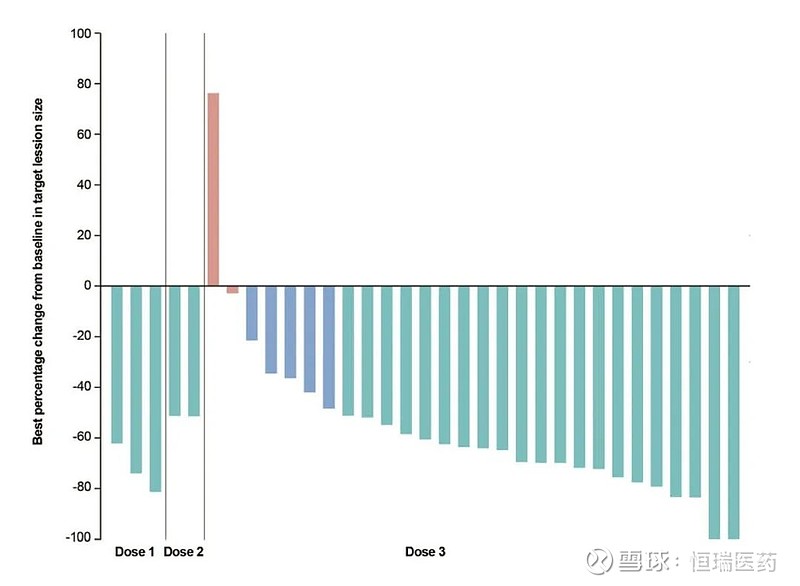
图2. 晚期胃/胃食管结合部腺癌患者
对联合疗法响应的瀑布图
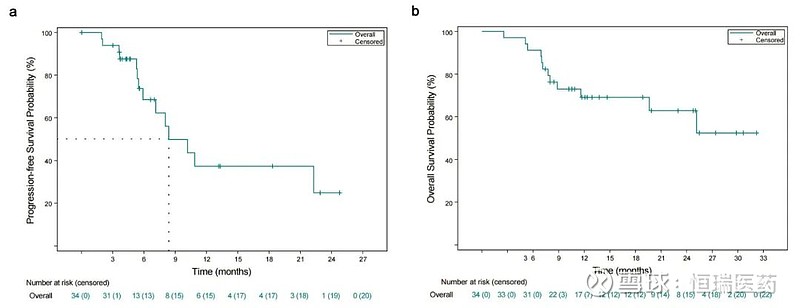
图3. PFS(左)和OS(右)的KM曲线
探索性分析
采用多重免疫荧光染色对29个基线样本和7个手术样本(包括4个配对的基线手术-样本)进行肿瘤免疫微环境评估。结果显示,患者治疗后三级淋巴结构(TLS)比例(57.1%vs.13.8%)显著增加(p=0.03)。在4例有配对的基线-手术样本的患者中,3例基线TLS阴性的患者在手术样本中检测到了TLS。这说明联合疗法刺激了TLS形成,诱导产生持久的抗肿瘤免疫反应,而TLS的存在与多种实体瘤免疫治疗的良好预后密切相关,是联合疗效的潜在的作用机制。此外,肿瘤基线高CD3+、Foxp3+细胞浸润的患者有更长的生存期(未成熟vs.19.6个月,风险比[HR]=0.20,95%CI:0.04-0.91,p=0.021;未成熟vs.19.6个月,HR=0.25,95%CI:0.05-1.15,p=0.054)。
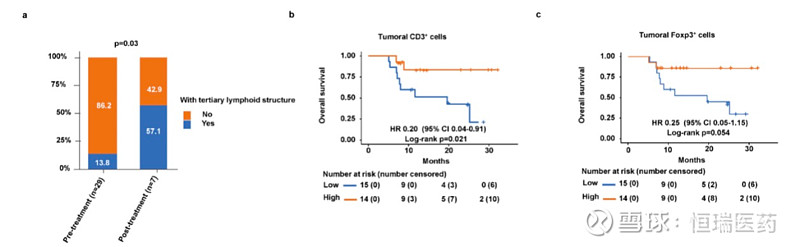
图4. TLS的变化和T细胞的预后分析
结论
SPACE研究是首个评估卡瑞利珠单抗联合阿帕替尼和化疗一线治疗的晚期胃癌的研究,研究结果显示:在接受治疗的34例患者中,确认的ORR为76.5%,中位PFS为8.4个月,中位OS尚未成熟(11.6个月-NE),中位EFS为22.3个月,两年的OS率为62.8%;10例患者治疗后,在多学科团队评估后接受手术治疗,与未手术患者相比,手术患者的EFS和OS更优(中位EFS:23.1vs.8.4个月;中位OS:未达到vs.19.6个月),且安全可控,有望为晚期胃癌患者一线治疗提供一种新的治疗选择。
作为创新型国际化制药企业,恒瑞医药多年来针对高发肿瘤领域持续开展科研攻关。公司累计研发投入近400亿元,已获批上市16款创新药,其中抗肿瘤创新药占比过半,另有80多个自主创新产品正在临床开发,270多项临床试验在国内外开展。未来,恒瑞医药将继续坚持“以患者为中心”的理念,努力研发出更多的新药好药,服务健康中国、造福全球患者。
参考文献:
[1]. Chen, X., Xu, H., Chen, X. et al. First-line camrelizumab (a PD-1 inhibitor) plus apatinib (an VEGFR-2 inhibitor) and chemotherapy for advanced gastric cancer (SPACE): a phase 1 study. Sig Transduct Target Ther 9, 73 (2024). 网页链接
[2].Sung, H. et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J. Clin. 71, 209–249 (2021).
[3].中华医学会肿瘤学分会, 中华医学会杂志社. 中华医学会胃癌临床诊疗指南(2021版)[J] . 中华医学杂志, 2022, 102(16) : 1169-1189.
[4].Smyth, E. C. et al. Gastric cancer. Lancet 396, 635–648 (2020).
[5].Fukumura, D. et al. Enhancing cancer immunotherapy using antiangiogenics: opportunities and challenges. Nat. Rev. Clin. Oncol. 15, 325–340 (2018).
[6].Saeed, A., Park, R. & Sun, W. The integration of immune checkpoint inhibitors with VEGF targeted agents in advanced gastric and gastroesophageal adenocarcinoma: a review on the rationale and results of early phase trials. J. Hematol. Oncol. 14, 13 (2021).
[7].Finn, R. S. et al. Atezolizumab plus bevacizumab in unresectable hepatocellular carcinoma. NEJM. 382, 1894–1905 (2020).
[8].Choueiri, T. K. et al. Nivolumab plus cabozantinib versus sunitinib for advanced renal-cell carcinoma. NEJM. 384, 829–841 (2021).
[9].Socinski, M. A. et al. Atezolizumab for first-line treatment of metastatic nonsquamous NSCLC. NEJM. 378, 2288–2301 (2018).
[10].Tian, S. et al. YN968D1 is a novel and selective inhibitor of vascular endothelial growth factor receptor-2 tyrosine kinase with potent activity in vitro and in vivo. Cancer sci. 102, 1374–1380 (2011).
[11]. Zhao, S. et al. Low-dose apatinib optimizes tumor microenvironment and potentiates antitumor effect of PD-1/PD-L1 blockade in lung cancer. Cancer Immunol. Res. 7, 630–643 (2019).
[12].Meng, X. et al. Camrelizumab plus apatinib as second-line treatment for advanced oesophageal squamous cell carcinoma (CAP 02): a single-arm, openlabel, phase 2 trial. Lancet Gastroenternol. Hepatoi. 7, 245–253 (2022).
[13].Xu, J. et al. Camrelizumab in combination with apatinib in patients with advanced hepatocellular carcinoma (RESCUE): a nonrandomized, open-label, phase II trial. Clin. Cancer Res. 27, 1003–1011 (2021).
[14].Qin, S. et al. Camrelizumab plus rivoceranib versus sorafenib as first-line therapy for unresectable hepatocellular carcinoma (CARES-310): a randomised, openlabel, international phase 3 study. Lancet 402, 1133–1146 (2023).
[15].Peng, Z. et al. Camrelizumab combined with chemotherapy followed by camrelizumab plus apatinib as first-line therapy for advanced gastric or gastroesophageal junction adenocarcinoma. Clin. Cancer Res. 27, 3069–3078 (2021).
声明:
1.本新闻旨在分享学术前沿动态,仅供医疗卫生专业人士基于学术目的参阅,非广告用途。
2.恒瑞医药不对任何药品和/或适应症作推荐。
撰稿:中央医学
排版:马瑞璘
责编:李玉莹
往期精选
| 研发创新 |
恒瑞医药新突破!中国首个自研阿片类镇痛创新药富马酸泰吉利定获批上市
代谢领域再下一城!恒瑞医药糖尿病创新药瑞格列汀(瑞泽唐®)获批
| 国际化 |
恒瑞医药“双艾”组合肝癌一线治疗适应症美国申报上市获FDA受理
| 重磅奖项 |
三度蝉联,再续荣耀︱恒瑞医药获2024“中国杰出雇主”认证
| 社会公益 |
“健康中国行·重走长征路”项目启动仪式圆满举行!恒瑞提供公益支持,助力健康中国
恒瑞医药集团向中国扶贫基金会捐赠3000万设立“健康帮扶基金”