对万春来说,12月的开局并不好,其收到了FDA的完整回复信(CRL),要求在其化疗诱导的中性粒细胞减少症(CIN)联合药物获得批准之前再做一次三期临床试验。公司市值重挫60%。
万春是由黄岚博士于2010年创立,总部位于纽约。2007年,黄博士联合创立无锡MTLH,2010年担任首席执行官,并继续担任董事。无锡MTLH生物技术有限公司设计的多肽类药物在中国的license于2010年卖给了上海医药。普那布林是万春的主要资产,是一种选择性免疫调节微管结合剂(SIMBA),可诱导抗原呈递细胞(APC)。普那布林可以触发免疫防御蛋白GEF-H1的释放,从而抵消了中性粒细胞(白细胞)的异常低水平。这也为该药成为非小细胞肺癌(NSCLC)的有效治疗提供了理由,目前该药正与多西紫杉醇联合进行III期研究。
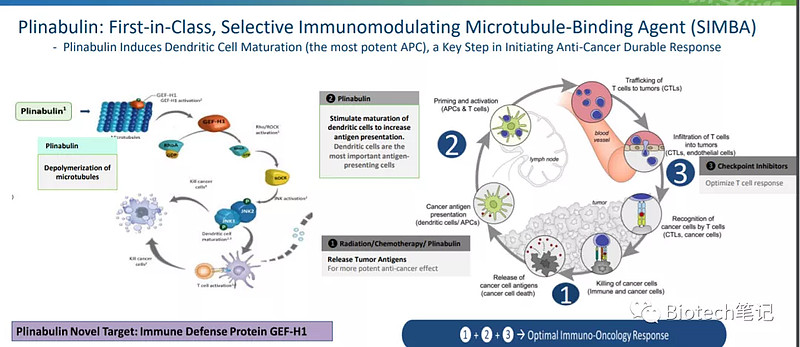
中性粒细胞减少(CIN)是一种常见的化疗副作用,特别是在肺癌患者中,它可以导致患者器官感染并导致治疗延迟,因为中性粒细胞减少限制了细胞毒性药物的剂量。2020年9月,普林布林获得FDA和中国药物评估中心(CDE)关于预防CIN的突破性疗法称号。
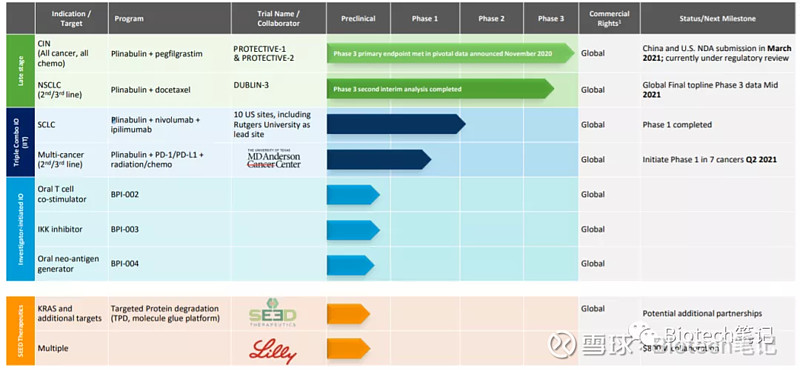

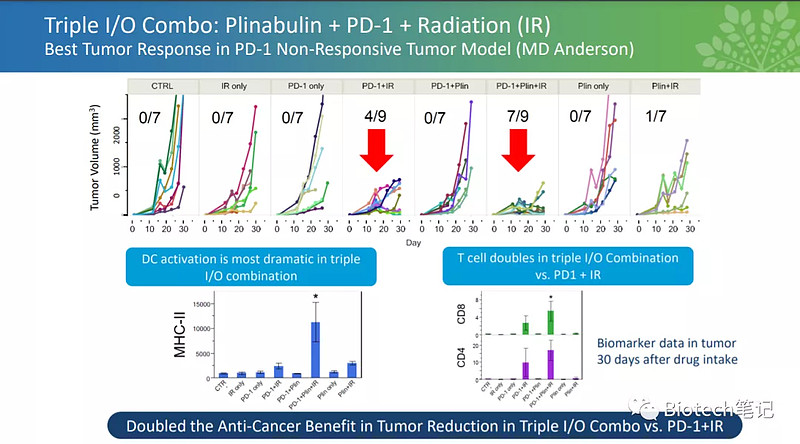
万春的管线除了普那布林,其他都是相对早期的药物和化合物,治疗领域主要是肿瘤,包括IKK,T细胞激动剂、KRAS的PRTAC疗法等等,管线基本都是化药。可以看出来万春还想推普纳布林联合PD-1治疗PD-1无响应的多肿瘤适应症,PD-1无响应实体瘤的市场是相当之大的,从数据看,biomarker和肿瘤体积PD-1联合普纳布林的肿瘤体积明显降低,MHC和CD8明显升高。普纳布林一度被誉为激活免疫的“神药”,最近FDA发CRL对万春实属重大打击。
普纳布林的NDA于 2021年6月提交普,提交的数据是PROTECTIVE-2三期临床试验结果,结果表明药物组合达到主要终点,提高预防4级中性粒细胞减少从13.6%降至31.5%。试验还达到了所有关键的次要终点,包括严重中性粒细胞减少的持续时间和绝对中性粒细胞计数(ANC)最低点。这些数据是与5个支持性临床试验一起提交的,临床入组共有超过1200名患者。
黄岚博士在一份声明中回应了这一消息:
她说:“坚信普那布林联合G-CSF用药有显著的提高CIN的治疗潜力,公司计划与FDA召开会议,并将继续致力于将普那布林带给全球需要帮助的癌症患者的目标。”
8月,万春宣布普那布林联合多西他赛治疗二线和三线NSCLC的试验结果。与单独使用多西他赛相比,联合使用达到了增加总生存期(OS)的主要终点,并显著降低了4级中性粒细胞减少的发生率。万春计划在2022年上半年向FDA提交普那布林的NDA。
结论:单单看普那布林这款药物,其激活免疫系统和升白的机制是很明确的,这次FDA之所以在回复函中拒绝NDA申请,笔者猜测有一定概率是因为人种差异问题,万春在中国和东欧选取的样本数量是够的,但是样本可能不够diversified,后期在设计三期临床的过程中,肯定会就这一点采取措施的,万春现在改变临床设计和申报策略,大概率其药物在2022到23年还是可以申报上市,其与PD-1联用治疗PD-1无响应的实体瘤会是万春的重磅,笔者还是乐观看待万春的未来,当然需要注意的是专利期的问题,其专利保护期又浪费了1-2年,万春市值60%的下滑是回到了2期临床估值,总体过于悲观了。笔者不持有任何万春的股票,与万春无任何业务往来。
美股梳理
阿里拉姆制药莫德纳辉瑞制药Sana Biotechnology Intellia
AH股梳理