


药苑杂谈 YAOYUANZATAN
1、什么是真实世界?
真实世界数据(real world data,RWD):
真实世界数据是指来源于日常所收集的各种与患者健康状况和/或诊疗及保健有关的数据。
真实世界证据(real world evidence,RWE):
真实世界证据是指通过对适用的真实世界数据进行恰当和充分的分析所获得的关于药物的使用情况和潜在获益-风险的临床证据,包括通过对回顾性或前瞻性观察性研究或者使用临床试验等干预性研究获得的证据。
并非所有的真实世界数据经分析后都能成为真实世界证据,只有满足适用性的真实世界数据才有可能产生真实世界证据。
真实世界研究(real world study,RWS):
真实世界研究是指针对预设的临床问题,在真实世界环境下收集与研究对象健康有关的数据(真实世界数据)或基于这些数据衍生的汇总数据,通过分析,获得药物的使用情况及潜在获益-风险的临床证据(真实世界证据)的研究过程。
2、与随机对照临床试验(RCT)的区别?
临床随机对照试验( randomized controlled trial,RCT)是评价药物有效性和安全性的“金标准”,被药物临床研究普遍采用;随机分组可以控制组间基线已知或未知影响因素的均衡,因此形成的证据可靠性较高。但 RCT 存在严苛的纳入排除标准,加之某些罕见病和重大疾病难以实施传统 RCT,以及需要高昂的时间成本等局限,使得临床真实世界证据( real world evidence,RWE)成为 RCT的有效补充。下图列举了RCT和RWE的主要区别。
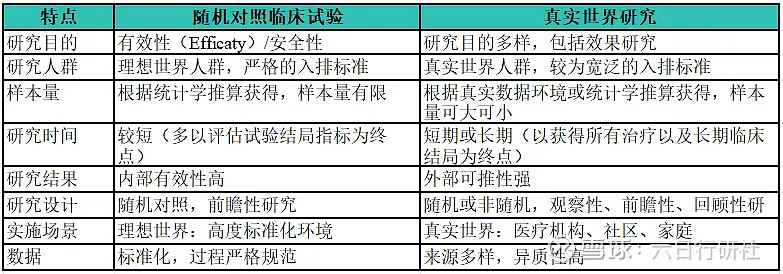

上图:RCT vs. RWS 人群
3、真实世界证据在临床试验中的角色有什么样的变化?
最初,RWE主要用于补充RCT的局限,如用于观察长期疗效和稀有不良事件,或为药物上市后监测提供数据支持。随后,随着监管机构对RWE的认可度提高,如美国FDA的《真实世界证据计划》,RWE开始与传统RCT并行,成为支持药物监管决策的有力证据近年来,RWE在某些场景下已开始主导临床试验设计,如单臂试验、篮子试验和自适应设计试验等,这些试验设计往往依赖于RWE来评估新疗法在更广泛患者群体中的实际效果。
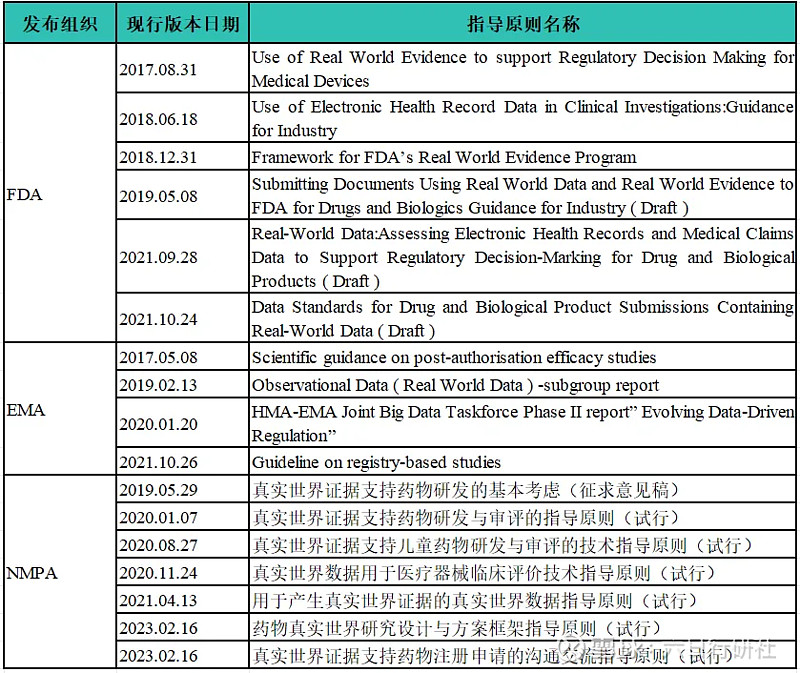
目前,我国系统性开展 RWD/RWE 科学监管体系建设工作尚处于起步阶段,美、欧、日等发达国家和地区正在加速深化布局。下图对比了各国各主要监管机构发布的RWD/RWE 科学监管体系建设相关政策法规和指导原则。
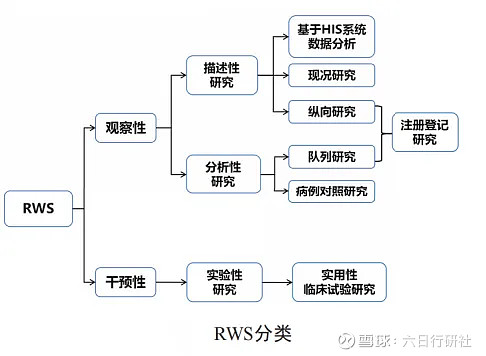
4、真实世界研究的分类?
根据研究者在开展 RWS 设计时是否采取干预措施,RWS可以分为观察性真实世界研究(observational real world study, ORWS)和干预性真实世界研究(interventional real world study, IRWS)。
对于 ORWS,可以根据是否设置对照组分为描述性研究(descriptive study)和分析性研究(analytical study)。描述性研究包括“基于健康信息系统(health information system, HIS)数据分析”“现况研究(cross-sectional study)”和“纵向研究(longitudinal study)”,而分析性研究包括经典的病例对照研究(case control study)和队列研究(cohort study),纵向研究和队列研究又可以统称为注册登记研究。
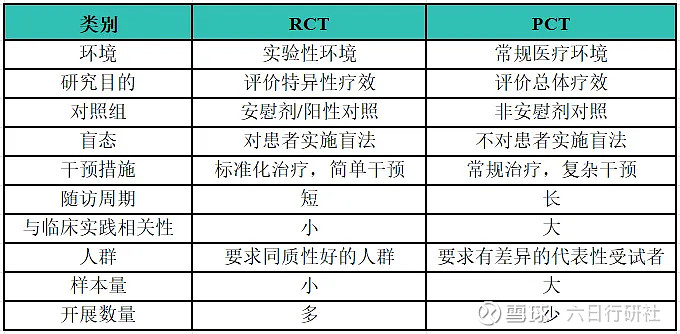
对于 IRWS,主要采用实用性临床试验(pragmatic clinical trial, PCT)开展。传统临床试验要求有严格定义和筛选的受试者、有经验的研究者以及较小的样本量开展,检验理想条件下干预措施的疗效,容易高估临床获益和安全性,可能不适合指导临床实践。为了揭示干预措施在真实世界人群中的有效性,PCT 的开展十分必要,其研究对象的纳入条件相对宽泛,干预措施贴近临床实际,研究结论有更好的临床适用性,受到广泛关注。
RCT和PCT的比较
5、未来真实世界研究的展望
应用场景的扩展:RWS的应用将不仅局限于药物研发领域,还将进一步扩展到医疗器械、诊断试剂等其他医疗健康领域。在药物全生命周期中,RWS的应用将更加广泛,从上市前的临床研究到上市后的疗效评估、安全性监测、用法用量优化等,RWS都将发挥重要作用。
政策支持与投入增加:随着全球范围内对RWS重要性的认识加深,各国政府和监管机构将出台更多政策来支持和推动RWS的发展。中国政府近年来已经加强了对RWS的政策支持,包括发布关于RWD收集、管理和使用的指导原则,以及推动电子健康记录系统的普及和完善等。
技术进步与数据质量提升:大数据、人工智能等技术的应用将极大地提升RWS的数据处理和分析能力,使研究更加精准和高效。电子健康记录(EHR)系统的发展和优化将提供更高质量的真实世界数据,为RWS提供坚实的基础。
数据标准化和质量控制的加强:为确保RWS的数据质量和可靠性,将制定更严格的数据标准化和质量控制措施。包括制定统一的数据收集和处理标准,实施严格的数据质量控制系统,以及对医疗从业者进行持续教育和培训等。
国际合作与交流的增加:随着RWS在全球范围内的普及和应用,国际合作与交流将不断增加。通过共享数据、交流经验和技术合作,各国将共同推动RWS的发展和应用。
对药物研发和监管的深远影响:RWS的发展将对药物研发和监管产生深远影响。通过提供临床试验之外的证据,RWS将帮助医疗决策者更全面地了解产品在常规临床环境中的表现,从而加速药物研发和上市进程。同时,RWS也将为监管决策提供实际数据支持,帮助优化政策制定和资源配置。
6、真实世界研究存在的不完善问题
数据质量和来源的多样性:真实世界数据来源众多,包括登记数据、医院病历数据、区域健康医疗数据等,数据质量有待评价。数据可能存在多源异构性,导致数据孤岛问题,数据可及性差,关键信息难以联通。数据的代表性、完整性和准确性都可能影响研究结果的可靠性。
偏倚和混杂的影响:RWS中通常存在较多的偏倚和混杂,如选择偏倚、信息偏倚等,这些偏倚可能使研究结果产生偏差。偏倚和混杂的来源多样,包括数据收集过程中的问题、患者群体的差异等。
研究过程透明化不足:研究过程的透明化没有得到足够重视,这可能导致数据的完整性和可靠性难以得到保障。缺乏对研究方案注册、统计分析计划发表、数据清洗方案制定等方面的公开和透明化要求。
隐私和数据安全问题:在RWS中,个人隐私和数据安全问题尤为重要,但这些问题并未得到妥善解决。需要加强个人隐私数据的保护,确保数据在收集、存储、分析和共享过程中的安全性。
顶层设计和规范化运行缺乏:医疗健康相关数据缺乏顶层设计和规范化运行,导致数据管理和使用的混乱。需要建立统一的数据标准和规范,确保数据的准确性和可靠性。
统计分析方法的挑战:RWS中的数据分析较为复杂,需要采用合适的统计分析方法来控制混杂和偏倚。常用的统计分析方法包括分层分析、多变量分析等,但在处理观察性研究时可能面临更大挑战。
伦理和合规问题:在RWS中,需要遵循伦理原则,确保受试者的权益和安全。同时,研究需符合相关法规和规定,避免出现违法违规的行为。
7、阶段性成果
2019年6月,国家药监局与海南省政府在乐城先行区联合启动临床真实世界数据应用试点,探索真实世界数据在药械产品注册和监管决策中的应用,为全国药械审评审批制度改革探索新工具、新标准和新方法。
截至目前,在特许药械政策、真实世界研究政策驱动下,乐城先行区已有29家医疗机构开业运营,进口使用临床急需特许药械超过400种,惠及患者7万多人次。
国家药监局医疗器械注册管理司有关负责人表示,通过在海南试点真实世界数据应用,国家药监局已累计批准4个药品、11个医疗器械注册上市,为患者带来最前沿的治疗手段。
其中就有先声药业与美国生物制药公司合作开发的全球创新药“科赛拉”注射用盐酸曲拉西利-全球首个在化疗前给药、拥有全系骨髓保护作用的创新药物。2021年2月,“科赛拉”在美国获上市批准。国内要上市这款药,按常规流程需开展三期临床试验,以测试药物对中国人群的有效性和安全性。“这一过程少则三五年,多则八九年。”2021年6月,海南先声药业通过乐城先行区的进口特许药械政策引进“科赛拉”,并实现国内首用,8月,该产品被纳入乐城先行区药品真实世界数据研究试点。借助乐城先行区“双国九条”政策,已经在国外上市但没有在中国境内上市的创新药械,可以在乐城先行区特许进口,患者通过申请后使用。对患者使用特许药械所产生的数据进行分析和整理,形成的真实世界研究证据可以用于特许药械在中国境内的上市申请。多方助力下,2022年7月,在美国首次上市17个月后,“科赛拉”便在国内成功注册并获批上市。如此快速的获批,大大降低了企业的研发成本和患者的用药负担。
随着“乐城研用+海口生产”模式的顺利开展,更多国际创新药械正排队启动国内上市和国产转化。例如,康哲药业与美国生物制药公司合作开发的创新药芦可替尼乳膏,用于治疗轻中度特应性皮炎,已落地乐城先行区特许使用,并开展真实世界研究。此外还有亚虹医药、华熙生物等海口高新区药企,也在借助乐城先行区政策实现产品的先行先试和研发……
预计RWE将在未来的临床试验中扮演更加核心的角色,特别是在精准医疗和个性化治疗领域。人工智能和机器学习技术的应用将进一步增强RWE的分析能力,使其更好地服务于临床研究和医疗决策。
参考文献:
1.汪旻晖,赵杨,邓亚中,等 . 真实世界数据/真实世界证据应用的政策法规及指导原则的比较研究 [J] . 中国临床药理学与治疗 , 2020, 25(8): 878-887.
2.聂晓璐,王胜锋,姚晨,等 . 国内外真实世界数据 /证据的相关药械监管政策法规及指导原则比较研究 [J] . 药物流行病学杂志 , 2022, 31(1): 5-11.
3.王瑞平 . 真实世界临床研究的分类和设计要点浅谈 [J]. 上海医药 , 2022, 43(23): 63-67.
往期回顾 Past Review
精准医疗时代下抗体药物的挑战与前景
关于我们 About Us
六日行研社聚焦于为医药行业的优秀从业者(产业、学术、研究、机构、资本)提供专业信息服务平台,分享行业经验与信息,希望能为中国医药信息整合及产业升级做出贡献,期待与中国医药产业链各个细分领域的优秀团队共同进步!