


药苑杂谈
YAOYUANZATAN
药械组合产品系指由药品与医疗器械共同组成,并作为一个单一实体生产的医疗产品。

申报原则
◆ 以药品作用为主的药械组合产品,应当按照药品有关要求申报注册;
◆ 以医疗器械作用为主的药械组合产品,应当按照医疗器械有关要求申报注册。
对于药械组合产品中所含药品或者医疗器械已获我国或者生产国(地区)批准上市销售的,相应的上市销售证明文件应当在申报注册时一并提交。药械组合产品的申报资料要求可参考相关文件和指导原则。
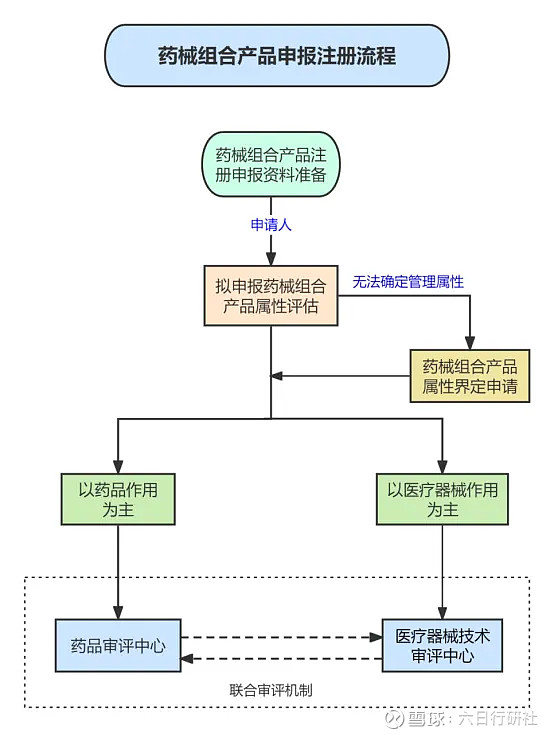
一、药械组合产品属性界定
申请人应当充分评估其拟申报药械组合产品的属性。对于药械组合产品不能确定管理属性的,申请人应当在申报注册前向国家药品监督管理局医疗器械标准管理中心(以下简称标管中心)申请药械组合产品属性界定。
申请人可通过中国食品药品检定研究院(标管中心)网站(网址:网页链接)下方的“业务大厅·重点专栏”栏目进入“医疗器械标准与分类管理”二级网站(网址:网页链接)
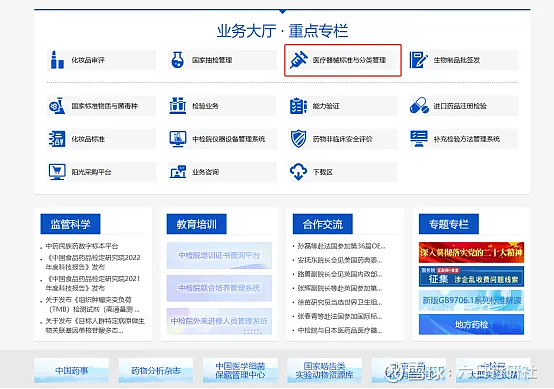
点击进入“药械组合产品属性界定信息系统”,填写《药械组合产品属性界定申请表》,并上传其他申请资料。
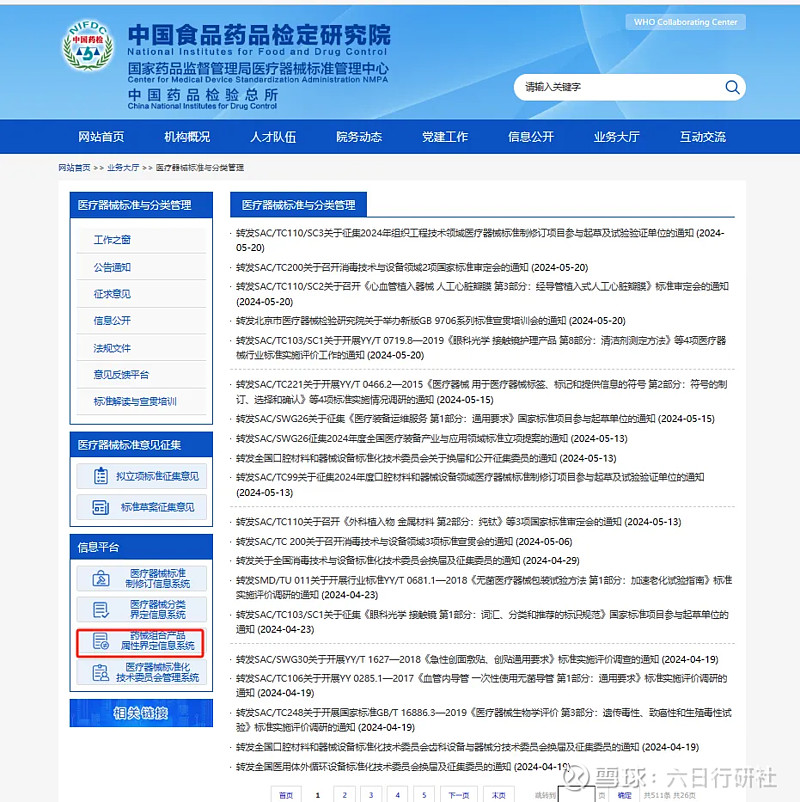
申请资料要求:

标管中心将对受理的药械组合产品属性界定申请资料进行审查,按程序提出属性界定意见,在药械组合产品属性界定信息系统中告知申请人,并在其网站对外公布药械组合产品属性界定结果。

二、审评机制及申报流程
申请人根据产品属性界定结果,向国家药品监督管理局申报药品或者医疗器械注册申请,并在申请表中注明“药械组合产品”。
2.1联合审评机制
国家药品监督管理局药品审评中心与医疗器械技术审评中心建立协调机制。
◆ 按照药品申报注册的药械组合产品,由药品审评中心牵头进行审评,需要联合审评的,注册申报资料转交医疗器械技术审评中心同步进行审评;
◆ 按照医疗器械注册申报的药械组合产品,由医疗器械技术审评中心牵头进行审评,需要联合审评的,注册申报资料转交药品审评中心同步进行审评。
◆ 对于联合审评的药械组合产品,药品审评中心与医疗器械技术审评中心应当协同开展申报产品的沟通咨询等工作;双方分别对相应部分的安全性、有效性及质量可控性出具审评报告,并明确审评结论,由牵头单位进行汇总并做出总体评价,出具总体审评结论后转入国家药品监督管理局相应业务司进行行政审批。
2.2申报流程图
总结
随着现代医疗高新技术的不断发展,生物技术、材料科学、医疗技术、药物制剂技术以及信息技术的交汇融合,为药品与医疗器械的创新注入了新的活力,药械组合产品应运而生。相较于单一的医疗器械产品或药品,其在提升治疗安全性、增强疗效、提高患者使用便捷性与舒适度等方面具有明显优势,可有效提升原本单一产品的效能,尤其是在慢性病管理、癌症治疗、心血管疾病等领域,药械组合产品展现出巨大的应用潜力,市场需求持续增长,这一新兴领域正逐渐成为行业焦点,目前也是研发的热点。
当前在我国药械组合产品的注册申报数量不断增加,属性界定申请数量也呈现出显著增长的趋势。药械组合产品正成为我国医药创新领域的重要增长点。未来,随着一系列创新性强、技术含量高、临床需求迫切的新型药械组合产品陆续上市,它们不仅将填补国内相关领域的空白,也将更好地满足广大人民群众的健康需求。
往期回顾 Past Review