


药苑杂谈 YAOYUANZATAN
自从国家药监局在2023年10月23号发布了“关于加强药品上市许可持有人委托生产监督管理工作的公告(2023年第132号)”文件以来,各省药监监管人员在B证现场核查时,也在配合相关文件不断收严B证的发证要求,监管的范围和力度也进行了加强。
和2020-2023年B证企业“大爆发”相对比,现在各省对委托生产企业,在《药品生产许可证》核准发放数量上也有明显下降,不仅如此,对于已经拿到B证的持有人,应该都接到了相关省局的常规检查或要求企业进行自查的通知,那么面对如今国家政策收严下的B证持有人,路在何方,持有人又应该如何平稳积极的推进呢?小编希望大家看完此文,对B证持有人今后道路有所帮助。
一.我国MAH制度的政策演变
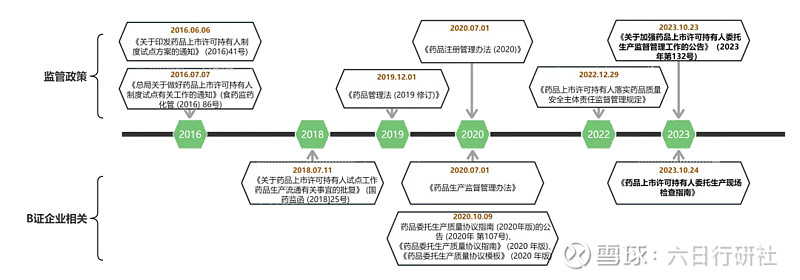
MAH制度政策演变至今,已经过去八个年头,药政部门对药品上市许可持有人的要求也在不断加强,尤其针对B证委托生产的持有人,国家仍然在不断完善法规。
从政策上看出,国家局正在不断加强对委托生产持有人的监管力度,要求委托生产的药品持有人对委托加工的产品要进行全程、全药品生命周期的质量管理监督;对于被监管的我们,除了正常应对药监部门的常规检查,更重要的是强化每个人自身对产品的责任意识。
二、新政策解读
我们对最新发布的《关于加强药品上市许可持有人委托生产监督管理工作的公告》和《药品上市许可持有人委托生产现场检查指南》进行解读:
1. 首先是持有人获得B证的难度加大
由于国家药监部门不断严控B证总体的数量,导致各个省局对新发生产药品许可证-B证的核发检查要求也在加强,从一开始的检查重点是针对质量管理文件体系的审核,到现在更加细致到注重持有人对关键岗位人员:生产负责人、质量负责人、药物警戒负责人的资质审查,尤其是广东省局,会对质量管理部门底下的QA,QC人员、药物警戒部门的药物警戒专员进行人员资质和在职在岗情况进行随机抽查,并对整个质量管理体系的建设和运行进行全方面检查,尤其对受托企业不在本省,而在外省的持有人,会查看双方的委托生产协议、质量协议、B证持有人对委托生产管理的文件,省局老师会严格考察B证的申请人是否具备履行质量安全主体的责任能力。
2. 对人员资质要求的提高
在132号文中明确了对质量负责人、质量受权人、生产负责人、药物警戒负责人的要求,详见下表

3.对部分产品细化监管规定
在132号文中,着重强调了对无菌药品、中药注射剂、多组分生化药等品种委托生产和对受托生产企业存在不良信用记录情形的监管规定。
针对委托生产中药注射剂、多组分生化药,要求持有人在申请准备阶段及委托生产期间,对受托生产企业以及中药提取物、动物来源原材料制备过程的药品GMP符合情况进行现场审核,对受托生产企业检验能力进行评估。
132号文还提出了持有人进行报告、派员驻厂管理等要求,并规定持有人所在地省级药品监管部门应当每年组织对持有人开展全面监督检查,对相关药品委托生产过程实施药品GMP情况进行延伸检查。
三、举例-新制度下持有人面临的实际问题
以广东省某B证企业举例,在企业最初申报B证核发时,因为涉及的委托生产的产品包含注射剂,但是在生产负责人资质材料里没有明确该人员从事的生产管理经验中是否有注射剂、药物警戒负责人从事不良反应工作年限未标明、提供委托生产企业通过GMP符合性检查报告资料等问题被省局老师告知要求补正;从上述需要补正的资料中可以看出,监管老师已经从原先仅线上审核资料是否齐全,到如今必须细化各个关键岗位人员资质,对受托生产企业审查要求的力度也在增大,我们总结出当下监管的重点内容:
1. 在人员资质方面
针对药品生产许可证的关键人员的个人简历,如果该人员之前从事的行业是在化工或者是医疗器械方面的,那么这段工作时间的工作经验是不能算在从事“药品相关岗位”的时间内,是需要扣除的,各个省局老师会严格审查人员简历中该名人员在之前每家企业每个岗位的在岗时间,不符合要求或者资料提供不明确的,省局老师会要求补正。
2. 关于驻场人员
在132号文-强化委托生产的质量管理模块,第14条中提出:“在委托生产药品期间,持有人应当选派具有相关领域生产和质量管理的实践经验、熟悉产品生产工艺和质量控制要求的人员入驻受托生产企业,对产品生产管理、质量管理全过程进行现场指导和监督,确保生产工艺、质量标准等符合法规要求;派驻人员工作职责应当在质量协议中予以明确。”目前该条仅针对了生物制品、中药注射剂、多组分生化药委托生产的企业。
这条的提出,是药监部门加大了对生物制品、中药注射剂、多组分生化药委托生产企业监管的体现,但是目前国家的相关法律法规还没有明确的意见出台,但是按照当下的监管政策来说,驻场人员政策的出台仅仅是时间问题,在这段时间内,我们持证企业就需要慢慢补上驻场人员,并制定相关文件对驻场人员进行培训、约束和管理。
总结
俗话说:图功易,成功难,成功易,守功难;对于还没拿到B证的药品企业,需要不断完善自身质量管理体系,需要具备履行药品质量安全主体的责任能力;对于已经拿到B证的药品企业,不能暗自庆幸,放松警惕,仍要全面落实对药品研发、生产等质量管理全过程中对药品安全性、有效性和质量可控性的主体责任。
往期回顾 Past Review
☀【受理日报2024.5.15】CDE受理;酒石酸阿福特罗雾化吸入用溶液点评