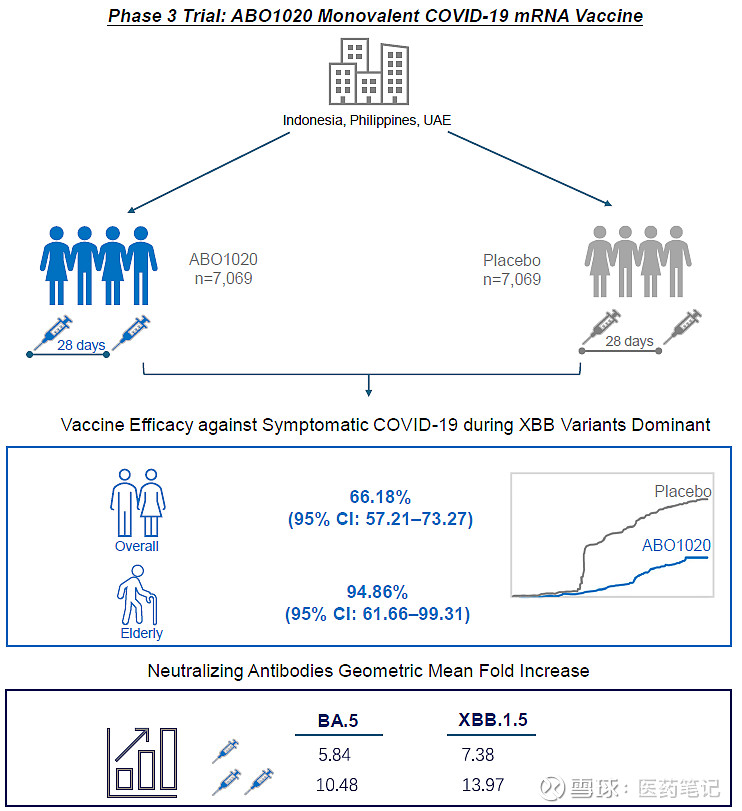
2024年7月17日,Cell出版社医学旗舰刊Med发表了艾博生物新冠变异株(BA.4/5)mRNA疫苗(代号:ABO1020)的三期保护力临床数据。根据艾博生物此前通过企业公众号及各公开场合发布的消息,ABO1020基于其专利自主的mRNA-LNP技术平台迭代研发,可在2-8℃稳定储存运输且无国际专利风险。

随着新冠疫情的消退,对于新冠疫苗的市场需求不断降低。在新冠疫情中乘风而起集众多优势于一身的mRNA技术,仍以其独特优势被寄予厚望,成为未来创新疫苗发展的重点方向。作为与沃森生物终止合作后,首个发表的由艾博团队独立完成的国际多中心三期保护力临床研究,研究结果及分析洞见如何?在此我们对这项研究主要和值得关注的结果,及其相关的探讨进行解读和简评。
ABO1020三期临床采用随机、双盲、安慰剂对照设计,评价在既往接种2剂或3剂新冠灭活疫苗人群中接种2剂ABO1020的疫苗效力、免疫原性和安全性。研究主要终点为2剂接种后14天起发生的有症状的PCR阳性病例。所有终点病例均经过终点评估委员会(EAC)评估确认。
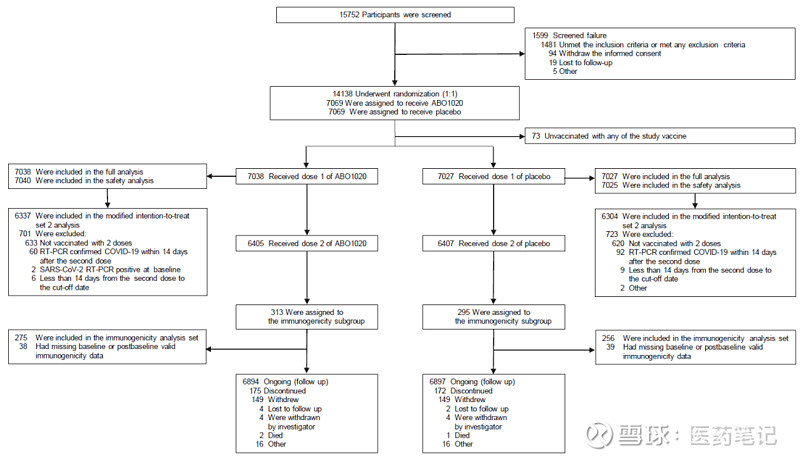
该三期临床在境外3个国家(阿联酋、菲律宾、印度尼西亚)16家研究中心开展,招募了14138名18岁及以上受试者,研究从2022年12月启动至2023年4月主要分析,用时4个多月完成入组接种和366例终点病例收集。
保护率
1) 主要终点保护率为66.18%(95% CI: 57.21–73.27, p
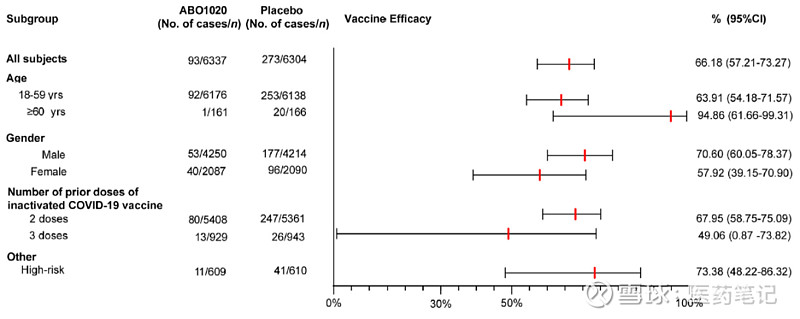
2) 亚组分析中,ABO1020在≥60岁老年人群中的保护率为94.86%(95% CI: 61.66-99.31)。鉴于研究中老年人群样本量较少(349例),现有数据显示的老年人群中保护率更高的趋势有待在更大样本量人群中进一步验证。
值得关注的是,研究中≥60岁老年人和患有基础疾病人群的高风险人群共1,219例,该人群中的保护率为73.38%(95% CI: 48.22-86.32),一定程度提示了ABO1020对于高风险人群的保护作用。
3)另一项有趣的亚组分析显示,ABO1020在既往接种3剂新冠灭活疫苗人群中的保护率低于既往接种2剂新冠灭活疫苗的人群。文章中对这一差异的可能原因进行了分析讨论,认为一方面可能与既往接种更多剂次原型株新冠灭活疫苗带来的免疫印迹有关,类似差异在此前曹云龙教授已发表的研究结果中亦有报道。此外,既往接种3剂新冠灭活疫苗的人群样本量(2,162例)相对既往接种2剂者(11,903例)较少,也可能是该亚组人群中保护率结果较低且95%CI较宽的影响因素之一。
免疫原性
ABO1020采用2剂接种程序,相对于在基础免疫人群中序贯加强接种1剂,无疑增加了完成免疫的流程和时间。文章中结合中和抗体实际评价结果和已报道的免疫机制研究,探讨了接种2剂的必要性和合理性:
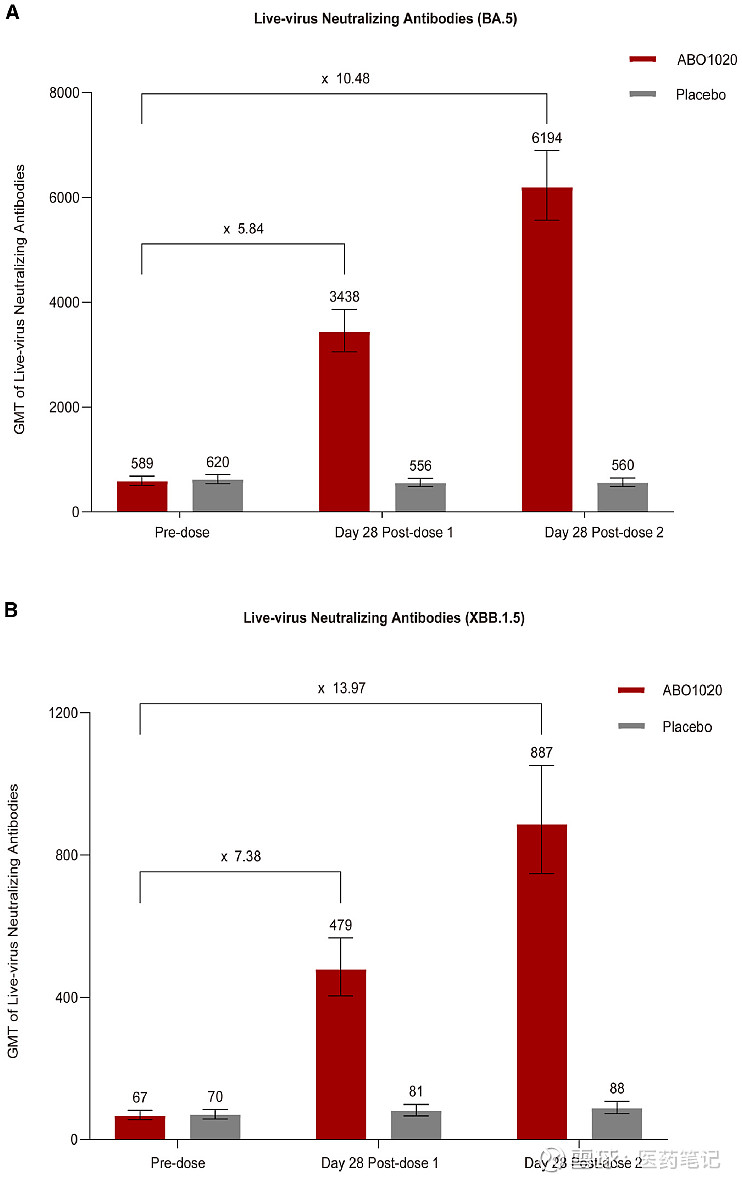
1) ABO1020接种1剂后,对Omicron BA.5和XBB.1.5真毒中和抗体GMT增长倍数分别为5.84及7.38;接种第二剂后,中和抗体GMT进一步升高,分别是接种前的10.48倍 及13.97倍。尽管BA.4/5的抗原序列在研究期间已不是当时主要流行株(XBB及其亚分支),中和抗体结果显示了接种2剂ABO1020强烈的免疫原性和交叉中和能力。
2) 这一结果印证了近期报道的一项关于免疫印迹机制的研究结果,即重复接种变异株特异性的疫苗可打破因感染原型株或接种原型株疫苗建立的免疫印迹效应。从而阐明了对于之前未接种过含Omicron株新冠疫苗或未感染过Omicron株的人群,加强接种2剂是应对新突变株更推荐的接种策略。
3) 此外,我国人群既往以接种灭活新冠疫苗为主,目前接种mRNA 疫苗的人群较少, 对于mRNA 疫苗naïve 的人群,可能首次接种2剂mRNA 疫苗是更合理的策略,类似Moderna SPIKEVAX和辉瑞 COMIRNATY基础免疫也采用了接种两针的策略。
安全性
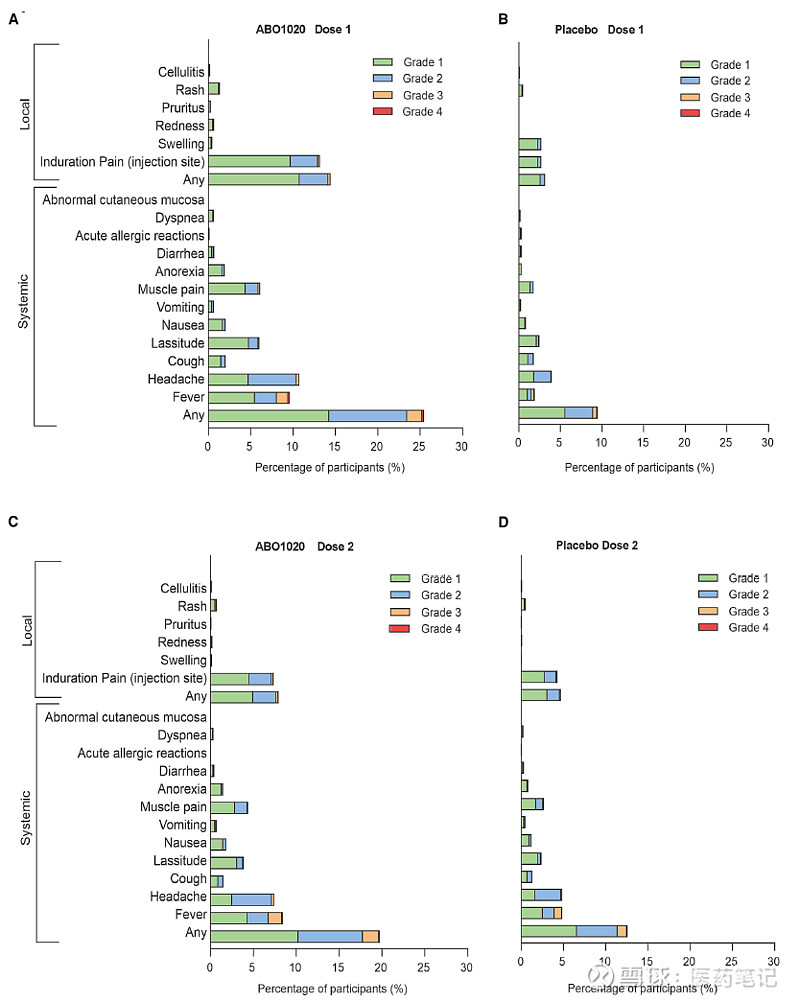
安全性一直是mRNA疫苗关注的首要问题。从文章呈现的安全性数据来看,多数不良反应为1/2级,如短暂发热、注射部位疼痛和头痛。文章也对不同剂次、不同年龄人群中的安全性数据做了讨论:
1)第2剂接种后不良反应发生率较第1剂接种后降低,这一现象与辉瑞COMIRNATY疫苗第2剂接种后不良反应发生率高于第1剂不同,可能与疫苗本身免疫特性或研究人群的耐受情况等有关。
2)老年人中的不良反应整体低于青壮年,尽管样本量有限,但综合保护率及安全性结果,为在老年人群中的获益/风险评价留下了一个积极的信号。
总结
总体而言,艾博生物ABO1020 mRNA疫苗的全球三期临床试验达到了预期的评价目的和标准。同时基于体液免疫评价结果和免疫机制,阐明了针对国内主流的2剂新冠灭活疫苗建立的免疫保护相对弱的实际情况,通过首次接种2剂mRNA疫苗,可突破免疫印迹,面对新的突变株提供有效的交叉保护。
该项研究尚存在若干局限,包括老年人群和既往接种3剂新冠灭活疫苗的人群样本量相对较少,对应亚组分析的结果有待于在更大样本量人群中进一步观察和验证。免疫原性亚组仅对体液免疫真病毒中和抗体进行了检测,缺少细胞免疫反应的检测数据和相关分析,如能在未来研究中补充探索,或可从细胞免疫方面进一步讨论在基础免疫新冠灭活疫苗的人群中首次接种2剂mRNA疫苗的必要性。
2024年4月,WHO COVID-19疫苗成分技术咨询小组(TAG-CO-VAC)建议在未来的COVID-19疫苗配方中使用单价JN.1谱系作为抗原。尽管ABO1020抗原序列BA.4/5已非当前主要流行株,就该项三期临床的数据结果而言,不失为艾博生物的mRNA-LNP技术平台交上了一份可圈可点的答卷。后新冠时代,mRNA技术更广阔的应用发展方向以及国内mRNA赛道新一轮的竞争格局成为近期业内探讨的热点。RSV mRNA疫苗已经获批上市,流感mRNA疫苗三期临床获得成功,肿瘤方面新抗原mRNA疫苗取得阶段POC的成功。mRNA疫苗在肿瘤治疗、传染病毒等领域都有广阔的应用前景并已经陆续完成临床概念验证。艾博生物在mRNA技术平台临床验证之后,能否推进后续更多产品管线的开发,我们拭目以待。