作者:林出
微信公众号:蹊之美股生物医药 / CaesarBiotech
标的公司:ERYTECH Pharma (NASDAQ & EURONEXT: ERYP)
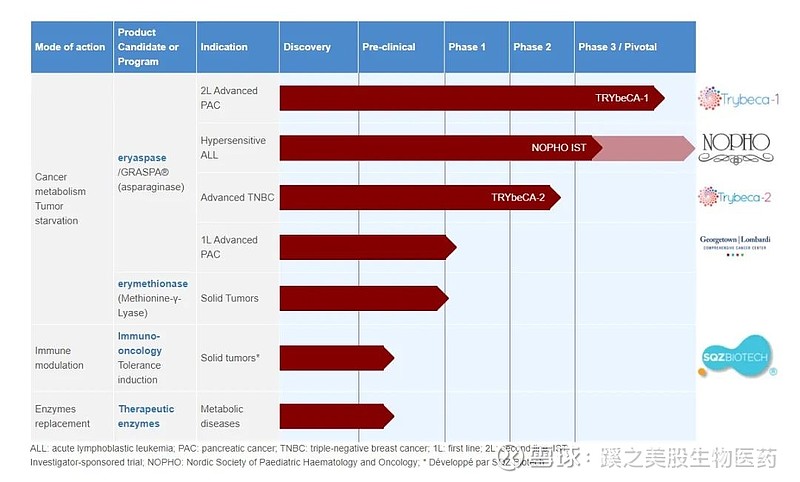
ERYTECH Pharma(EYRYY)宣布,美国食品和药物管理局(FDA)已授予eryaspase治疗急性淋巴细胞白血病(ALL)患者药物过敏反应(对E. coli-derived聚乙二醇修饰门冬酰胺酶(PEG-ASNase)。

2020年12月宣布的II期eryaspase治疗聚乙二醇化天冬酰胺酶(pegylated asparaginase)过敏ALL儿童患者的安全性和酶活性积极结果表明,每两周服用一次eryaspase与化疗相结合,可提供持续的天冬酰胺酶活性水平,并且通常耐受性良好,很少出现过敏反应。
公司预计在2021年Q4提交生物制剂许可证申请(BLA)。
2020年4月,eryaspase被授予快速通道指定,用于开发转移性胰腺癌患者的二线治疗。该适应症的III期试验于2021年1月完成,最终结果预计将在2021年Q4公布。
急性淋巴细胞白血病
急性淋巴细胞白血病(ALL)是一种血液和骨髓癌,是美国和欧洲儿童最常见的癌症类型。在美国和欧洲,每年约13000多个病例,其中大多数患者在20岁之前诊断。高达30%患者有治疗相关天冬酰胺酶(Asparaginase)超敏反应。ALL患者停用天冬酰胺酶治疗均与较低的无事件生存率相关,表明需要额外的天冬酰胺酶治疗方案。
ERYTECH和EryaPase
ERYTECH是一家临床阶段的生物制药公司,开发基于红细胞的创新疗法,用于治疗严重癌症和孤儿疾病。利用其专有的ERYCAPS®平台,使用一种新技术将药物封装在红细胞内,ERYTECH正在为高度未满足医疗需求的患者开发一系列候选药物。ERYTECH主要开发目标是通过剥夺癌细胞生长和存活所需的氨基酸,以改变癌细胞的代谢。
该公司的主要管线,eryaspase,由包封在供体来源的红细胞内的L-天冬酰胺酶组成,靶向癌细胞改变的天冬酰胺和谷氨酰胺代谢。Eryaspase正在进行二线胰腺癌治疗III期临床开发,预计将于2021年Q4公布最终结果,并正在进行II期三阴性乳腺癌治疗。一项由研究者赞助的急性淋巴细胞白血病II期试验(IST)在最近公布积极结果,1L晚期胰腺癌的I期IST正在进行中。
Eryaspase获得美国食品和药物管理局(FDA)的快速通道指定,用于治疗对PEG-ASNase过敏的晚期胰腺癌患者。FDA和欧洲药品管理局已经批准了Eryapase治疗胰腺癌和ALL的孤儿药指定。
蹊之美股生物医药 / CaesarBiotech
追踪和剖析全球最前沿生物科技公司,寻找低估值/革命性的生物科技产品或技术平台,深入挖掘其投资价值。
联系方式:CaesarBiotech@aliyun.com
本文首发:蹊之美股生物医药
版权声明
本文原创,如需转载请联系授权