作者:林出
微信公众号:蹊之美股生物医药 / CaesarBiotech
标的公司:Cerecor Inc.(NASDAQ: CERC)
Cerecor Inc.(CERC) 宣布Ib期first-in-class全人源anti-LIGHT(TNFSF14)单克隆抗体CERC-002概念验证研究的初步积极结果,针对中重度克罗恩病(CD)成人患者。

Ib期,开放标签,剂量递增,信号发现,多中心研究,旨在评估CERC-002在成人中重度活动性克罗恩病患者中的安全性、耐受性、药代动力学和短期疗效。这项试验性研究,采用剂量递增设计。旨在初步评估皮下注射(SQ)两种剂量的CERC-002–每两周1 mg/kg和每两周3 mg/kg 。该治疗期为8周,即对入选受试者进行全程安全性评估,并在基线检查时进行结肠镜检查,然后在8周时再次进行结肠镜检查。根据克罗恩病(SES-CD)的简单内镜评分,参与研究的受试者必须有至少7分的中重度疾病,并且必须至少有一次抗TNF-α治疗失败。
经过8周的治疗,第一组(n=4)CERC-002受试者的主要初步疗效和安全性结果包括:
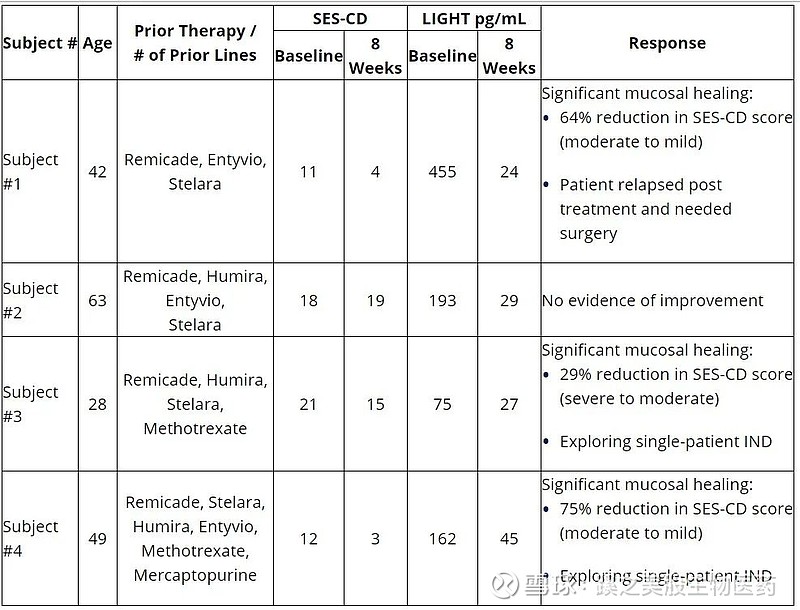
初步疗效结果
治疗后8周内反应迅速;
与基线相比,平均减少约80%的光照水平;
根据结肠镜检查(SES-CD评分),75%(3/4)的受试者在内镜下有临床意义的改善;
三个显示内镜下愈合的受试者探索了单一患者试验新药(IND)的应用;和
一名受试者(1/4)在治疗后复发,需要手术治疗。
初步安全结果
研究对象中观察到的不良事件为轻度至中度,最常见的不良事件与胃肠道和潜在的克罗恩病有关;
没有因治疗引起的严重不良事件;
无与免疫抑制相关的感染增加或不良事件的证据;
良好的安全性与CERC-002 COVID19 ARDS试验(16mg/kg单次剂量)一致。
根据数据结果,Ib期临床试验的独立安全性审查委员会批准继续剂量探索(n=4),无需修改方案。试验正在进行中,总时间约为26周。
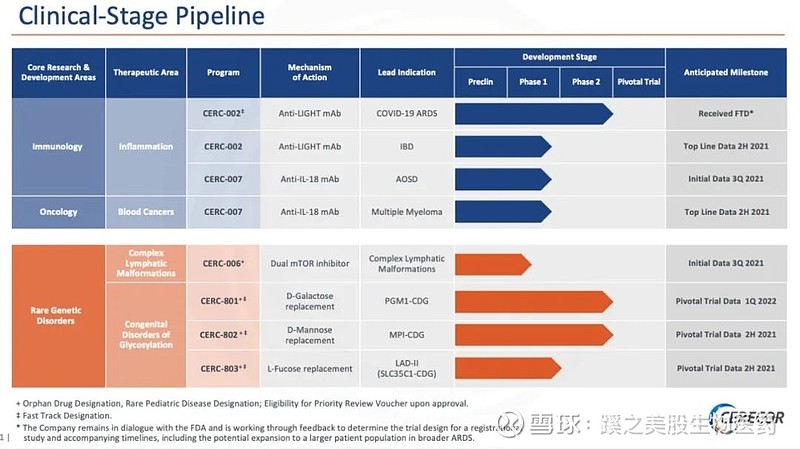
CERC-002(抗轻单克隆抗体)
CERC-002是一种完全人类anti-LIGHT(/TNFSF14)单克隆抗体(licensed from Kyowa Kirin Co.,Ltd)。是唯一的临床阶段anti-LIGHT治疗,并有潜力治疗多种光相关免疫疾病,包括cytokine storm-induced COVID-19 ARDS。Cerecor还与Myriad RBM合作开发高灵敏度血清/血浆LIGHT分析。
LIGHT在急性炎症反应中的作用
LIGHT(与淋巴毒素同源,表现出可诱导表达,并与HSVglycoprotein D竞争结合疱疹病毒进入介质(T淋巴细胞上表达的受体)是一种具有TNFSF14基因编码的炎症作用细胞因子。在调节肺、肠和皮肤的免疫反应中起着重要作用。可刺激T细胞和B细胞应答,并诱导其他细胞因子如IL-1、IL-6、IL-8、IL-10、TNF和GM-CSF的释放。因此,LIGHT在病毒性肺炎和其他疾病的免疫反应中可能起着关键作用。
Cerecor
Cerecor是一家生物制药公司,致力于成为免疫、免疫肿瘤和罕见遗传疾病治疗的开发和商业化的领导者。正在推进其创新疗法的临床阶段管线,以解决罕见和孤儿疾病中未满足的患者需求。该公司的罕见疾病管线包括CERC-801、CERC-802和CERC-803,用于治疗先天性糖基化障碍,CERC-006是一种正在开发用于治疗复杂淋巴管畸形的口服mTORc1/c2抑制剂。公司还开发了两种单克隆抗体,CERC-002和CERC-007。CERC-002靶向细胞因子 LIGHT (TNFSF14) ,正在临床开发中,用于治疗严重的儿童克罗恩病和COVID-19急性呼吸窘迫综合征。CERC-007以细胞因子IL-18为靶点,用于治疗Still病(成人Still病(AOSD)和系统性青少年特发性关节炎(sJIA))和多发性骨髓瘤(MM)。CERC-006、801、802和803都获得了孤儿药和罕见儿科疾病的资格,并都有资格获得FDA优先审查。
蹊之美股生物医药 / CaesarBiotech
追踪和剖析全球最前沿生物科技公司,寻找低估值/革命性的生物科技产品或技术平台,深入挖掘其投资价值。
联系方式:CaesarBiotech@aliyun.com
本文首发:蹊之美股生物医药
版权声明
本文原创,如需转载请联系授权