精准医疗是肿瘤治疗的发展方向,肿瘤基因检测是肿瘤精准医疗的基石。全球人口老龄化进程不断加深,肿瘤发病率持续攀升,药企、科研院所投入大量资源开发新靶点、新药物、新疗法,且药物靶标和新药研发一一对应的关系越来越精准,直接带动相关基因检测需求的快速增长;同时,肿瘤药物逐步纳入医保惠及更多患者,肿瘤诊疗行为进一步规范,刚性检测需求的渗透率将持续提升,为合规、领先企业带来更广阔的发展前景。
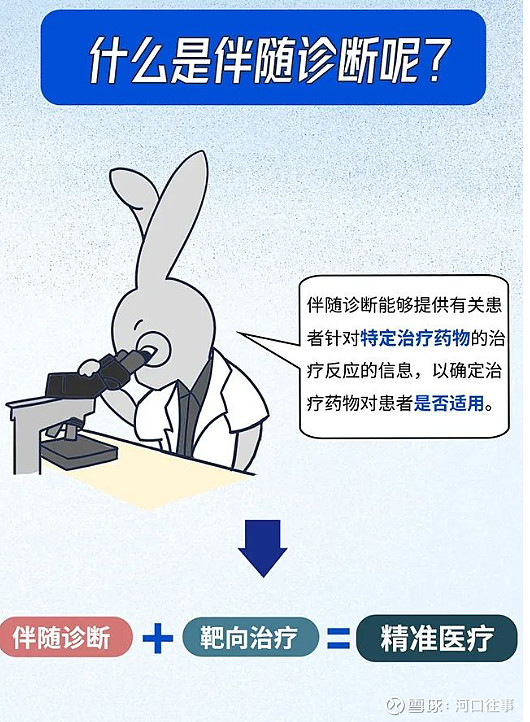
从长远看,肿瘤基因检测覆盖从肿瘤早期筛查、辅助诊断、伴随诊断、疗效监测、复发预测等肿瘤精准治疗全流程。目前,临床刚性检测需求是通过基因检测帮助制定治疗方案(即肿瘤药物的伴随诊断)。伴随诊断是与特定药物的临床应用相关联的体外诊断技术,通过检测药物临床反应相关的基因、蛋白等生物标志物的状态,筛选出合适用药人群,进行精准医疗。伴随诊断是肿瘤靶向药物、免疫药物精准使用的基础和前提,能够避免药物的误用和滥用,改善患者的生活质量,有效节约社会医疗成本。
1,什么是伴随诊断




2,公司的主要产品
(1)检测试剂、软件及配套仪器
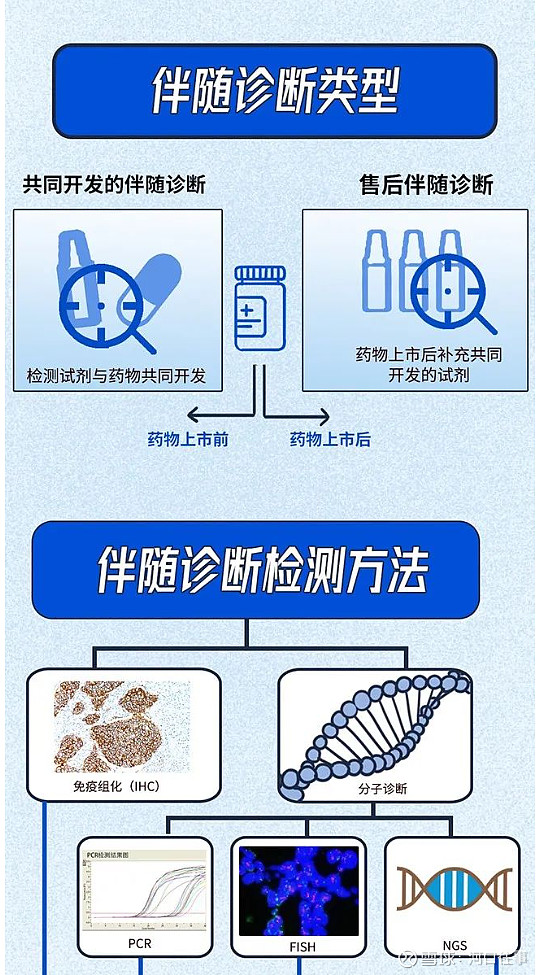
针对目前具备精准医疗条件的肺癌、结直肠癌、卵巢癌、前列腺癌、乳腺癌、甲状腺癌、黑色素瘤等癌种,公司以伴随诊断试剂为核心,打造了从上游的样本处理/核酸提取,到下游的自动报告和数据管理系统的肿瘤精准检测整体解决方案,技术平台涵盖主流的聚合酶链式反应(PCR)、二代测序(NGS)、免疫组织化学(IHC)、荧光原位杂交(FISH)等,并有配套仪器,可以全方位服务医院客户,帮助患者避免药物的误用、滥用,从精准医疗中最大受益。
截止目前,公司自主研发并在中国获批26种肿瘤基因检测产品(均属于监管要求最高的三类医疗器械,伴随诊断注册法规实施后,公司申请注册的产品均有伴随诊断标签),是行业内产品种类最齐全的领先企业,多个产品目前仍是国内独家获批产品,伴随诊断产品ROS1及PCR-11基因在日本等国家获批并纳入当地医保。在欧洲分子基因诊断质量联盟(EMQN)、国家卫健委病理质控评价中心(PQCC)组织的国内外室间质评中,公司产品连续多年保持优异的准确率和极高的使用率。
(2)检测服务
公司下设两家独立第三方医学检验机构——厦门艾德医学检验实验室、上海厦维医学检验实验室,拥有卫健委颁发的《医疗机构执业许可证》(医学检验科;临床细胞分子遗传学专业/病理科),具备开展细胞病理、组织病理、分子病理临检服务的资质和能力。两家实验室拥有PCR、NGS、IHC、FISH、Sanger、数字PCR(ddPCR)等多个技术平台,通过美国CAP认证和ISO15189认可,按照CAP、CLIA检测实验室运行标准进行管理和质量控制,同时依托公司强大的科研力量,可根据不同项目选择最优的技术平台进行LDT产品设计与开发,满足药企、科研机构的多种需求,承接并出色完成了众多知名药企重要肿瘤药物的临床试验研究工作,获得合作伙伴的高度认可。厦门艾德医学检验实验室获国家发改委批准,成为“肿瘤基因检测技术临床应用中心”单位,为全国肿瘤精准基因检测技术的临床应用起到标杆示范作用。
公司医学检验实验室严格遵守法律法规,质量管理体系完善、人员培训及时到位、硬件设施完备、充分落实生物安全防控和人类遗传资源管理,从分析方法确认、样本实验检测、生物信息分析、报告解读和发放、信息系统验证、室间质评与室内质控、仪器设备校准、试剂耗材管理、实验室安全等各个维度进行管理和质量控制,确保每一份检测报告的原始数据都可追溯;同时为了更好地维护送检客户的权益,所有检测项目均可通过官方公众号平台“艾德医学检验实验室”进行即时查询,每一份报告均有唯一的编码,可同步进行报告防伪验证查询。
(3)药物临床研究服务
随着新药研发难度和成本的不断增长,伴随诊断的价值愈发凸显,同时近年来我国伴随诊断注册法规陆续出台,进一步强调肿瘤药物伴随诊断的重要临床价值,肿瘤药物从临床试验到上市后临床应用均离不开伴随诊断试剂,药企选择好的伴随诊断合作伙伴,可以显著提高药物临床试验的成功率,并且可以加快新药上市后的推广速度。公司凭借从研发、生产、质控、注册到销售的整体优势,与AstraZeneca(阿斯利康)、LOXO ONCOLOGY(礼来制药子公司)、Johnson & Johnson(强生)、Pfizer(辉瑞)、Amgen(安进)、MERCK KGaA(默克)、EISAI(日本卫材)、Takeda(武田)、Pierre Fabre(皮尔法伯)、Hengrui(恒瑞)、BeiGene(百济神州)、CStone(基石)、HUTCHMED(和黄)等国内外众多知名药企达成伴随诊断合作,为其提供专业的中心实验室检测和伴随诊断注册服务,支持药物不同阶段的临床研究。药企选择伴随诊断合作伙伴的要求是相当苛刻的,对技术开发、生产质控、注册报批、管理体系都有极高的要求,能够达成伴随诊断合作是对诊断公司产品品质和企业品牌最高的认可。
3,公司的销售模式
公司所从事的肿瘤精准医疗分子诊断行业属于前沿热点领域,市场处于快速发展阶段,市场推广对于专业程度要求较高。在国内市场,公司采用“直销与经销相结合,直销为主、经销为辅”的销售模式,国内销售团队近400人,负责全国市场营销服务工作;在直销网络之外的市场,公司积极寻求与药企或经销商以产品代理的形式及旗下医学检验实验室以检测服务的形式进行覆盖。公司销售模式的选择符合产品特点和临床市场需求,也符合减少中间流通环节的医改政策导向。在国际市场,公司建立了覆盖全球60多个国家和地区的国际业务团队,积极寻求和当地经销商、终端、跨国药企的合作机会。
在国内市场方面:公司建立了覆盖国内头部500多家医院的直销网络,其职能包括市场调研、市场培训、学术推广、服务支持、渠道建设等。公司拥有近400人的销售团队以及完备的市场、医学、技术支持团队,为售前售后提供了有力保障;在直销网络之外的市场,公司积极与药企或经销商合作,通过产品代理和检测服务的形式进行覆盖,进一步拓宽了销售渠道。
在国际市场方面:公司国际业务及BD团队近70人,拥有100余家国际经销商,覆盖全球60多个国家和地区。公司在新加坡、香港、加拿大设有全资子公司,在荷兰设有欧洲物流中心,这些布局不仅提升了公司的国际影响力,也为产品的全球销售提供了有力支持。此外,公司与海外肿瘤专家、医疗机构、中心实验室、药企紧密合作,持续推进产品认证和市场准入,为产品的国际化奠定了坚实基础。同时公司产品还以伴随诊断方式参与多家药企原研药物的临床试验,全力开拓国际市场,也为公司的长远发展注入了新的动力。
4,2023年的经营业绩
2023年面对医疗行业的新形势,公司恪守合规要求,继续扩张国内院内市场,加快开拓国际市场,有效扩大药企合作。2023年公司营收首次突破10亿元,同比增长23.91%,进一步提升盈利能力,扣非后净利润超过2.3亿元,同比增长52.21%,扣非后净利润增速超过收入增速,创下历史新高,行业龙头地位更加稳固。
创新驱动:创新塑造新质生产力 持续满足临床及患者精准医疗需求
技术创新和塑造新质生产力是公司不懈的追求,艾德生物的研发始终以临床需求、患者受益为导向,现建有厦门、上海双研发中心,通过国家企业技术中心认定。2023年,公司研发人员503人,研发投入20,321.73万元,同比增长16.44%,占营业收入19.47%,新增9项发明专利授权。2023年,公司MSI(微卫星不稳定性)产品获批泛癌种免疫治疗伴随诊断第一证!国产高通量基因测序仪ADx-SEQ200 Plus获批上市!截至2023年底,公司已获批上市26个III类医疗器械注册证,在细分行业遥遥领先。
公司基于自主知识产权的专利技术,坚持以伴随诊断试剂为核心,打造了从上游的样本处理/核酸提取,到下游的自动报告/数据管理系统的肿瘤精准检测整体解决方案。在已经获批Ⅲ类IVD产品基础上,公司按照Ⅲ类IVD产品开发标准,储备了丰富的LDT产品线并正在进行注册报批(如指导卵巢癌/乳腺癌/前列腺癌/胰腺癌PARP抑制剂用药的HRD、HRR产品,指导泛癌种靶向治疗检测的Classic Panel,满足泛癌种多组学检测需求的Master Panel,以及多款分子分型、辅助诊断和肿瘤早测产品)。
国内市场:合规优势凸显 院内市场龙头地位不可撼动
2023年,面对国内医疗行业新形势,艾德生物恪守合规要求,专注主业,持续推进合规产品的医院准入,院内市场占有率进一步提升。2023年,公司国内销售1实现营收78,518.02万元,同比增长23.65%,其中院内检测试剂收入同比增长超过40%,合规优势凸显。随着肿瘤基因检测行业整顿的进一步深入,以及资本市场风险偏好降低、投资风格转变,合规的龙头企业有望多方获益。公司拥有一支近400人的专业化服务团队,从市场、医学、技术支持到商务,为国内头部500多家医院提供合规、高品质的创新产品;并且依托上海、厦门两家资质齐全的医学检验实验室,以Ⅲ类IVD产品注册标准开发LDT产品,响应试点医院建立LDT产品研发、制备、使用、质控体系的需求,推动LDT产品成熟后向IVD产品转化。
国际市场:加速海外市场准入 本地化团队助力全球化布局再上新台阶
参与国际竞争是企业打造国际品牌的重要举措,也符合国家鼓励和促进国内医药企业“走出去”的政策导向,艾德生物在国际市场开拓已经取得一定成绩的基础上,加速布局本地化团队进一步扎根国际市场,2023年,公司国际销售及药企商务实现营收25,832.65万元,同比增长24.68%。公司国际业务及BD团队近70人,与100余家国际经销商合作,在新加坡、香港、加拿大设有全资子公司,在荷兰设有欧洲物流中心,在新加坡、日本、欧洲、拉丁美洲、“一带一路”沿线等重点海外市场组建本地化团队,夯实东亚和欧洲市场的营销体系,逐步向东南亚、中东、非洲、拉丁美洲等市场拓展;与阿斯利康达成全球合作,推动HRD、HRR、BRCA等多项伴随诊断在全球多个国家或地区
1 国内销售指按公司经营管理分类的国内销售,而非按地区分类的国内。
的开发和商业化;PCR-11基因产品纳入日本医保后市场推广卓有成效,该产品在欧盟及海外其他地区的注册报批陆续完成后将带来更多收益;肺癌、肠癌、妇瘤、内分泌肿瘤及泛癌种等多管线产品新获欧盟、泰国、印度尼西亚、哥伦比亚、墨西哥、土耳其等国家/地区的准入。
药企合作:深化药物伴随诊断合作 药企朋友圈持续壮大
以伴随诊断赋能原研药物临床,推动更多、更好的治疗方式服务患者是艾德生物明确的战略方向。2023年公司药企朋友圈持续扩大,合作领域、区域不断扩展,从TKIs靶向药物、PARPi药物,到免疫治疗药物、ADC药物等,均实现了伴随诊断产品的前瞻性布局,把握未来市场的创新源头。公司在PCR、NGS、IHC、FISH等各技术平台均有成功的伴随诊断产品开发及注册经验。在PCR平台上,公司PCR-11基因产品是礼来、安进、默克、武田、皮尔法伯、海和、广生堂等十三家药企肿瘤药物的伴随诊断;在NGS平台上,NGS-10基因产品是强生、武田等药企肿瘤药物的伴随诊断,BRCA1/2产品是阿斯利康、百济神州等药企肿瘤药物的伴随诊断,HRD产品是阿斯利康等药企肿瘤药物的伴随诊断;在IHC平台上,PD-L1产品是默沙东帕博利珠单抗(K药)和恒瑞医药卡瑞利珠单抗的伴随诊断,HER2产品是百济神州等药企肿瘤药物的伴随诊断,MET产品是和黄医药等药企肿瘤药物的伴随诊断;在FISH平台上,HER2产品是百济神州等药企肿瘤药物的伴随诊断。目前,公司伴随诊断合作的EGFR、KRAS、BRCA1/2、MSI、IDH1、PD-L1等11个靶点的多款创新肿瘤药物已经获批上市。肿瘤药物伴随诊断的选择关系到药物临床研究的成败,关系到药物能否顺利获批,知名药企选择公司进行伴随诊断的合作开发,是对产品品质和企业品牌的最高肯定,也为公司拓展新的业务领域奠定了良好的基础。
5,公司的营收、利润增长水平

4年营收复合增速位15.93%,利润复合增速为17.92%。整体在IVD里面也还是非常不错的。主要是分子伴随诊断赛道是个非常好的赛道。

费用里面销售费用占比31%,虽然在IVD里面是比较高的,但是由于其特殊属性,所以此费用率还属正常,研发费用投入接近20%,在IVD里面是比较高的,接近疫苗的研发费用投入。
产品拆分:单位:亿元
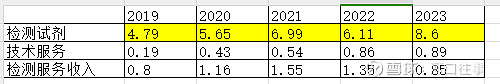
检测试剂及IVD诊断试剂,技术服务是和药企合作的项目,检测服务是指厦门和上海2个实验室产生的检测服务收入。
6,艾德生物与IVD商业模式初探
IVD商业模式的核心是卖水的,到处铺设饮水机,最终卖的是耗材,是水,依托的是检验的刚需。艾德更多的是回归了IVD本质中的本质,不简单铺设机器,卖的是试剂,做的是特色,主要是他的试剂是独家的,是技术领先于其他所有人的,而且肿瘤这个赛道足够大,天花板极高。加上独特的直销模式,海外也占营收20%,未来的成长空间还是比较大的。具体的需要进一步的研究。