
• Bolt和Silverback各自研发的抗体-TLR激动剂偶联物临床数据均未达预期。
• Silverback放弃肿瘤方向,Bolt坚持BDC-1001研发。
• Seven&Eight研发的BDB001在IO联用中初见成效。

这是2020年文章(《TLR激动剂能否重塑肿瘤免疫游戏规则》《PD-1耐药后TLR7/8激动剂能否带来转机》)的续篇。
2021年本应是TLR激动剂及相应的抗体偶联物公司完成概念验证、发布数据的时刻,但可惜的是,从ASCO到ESMO,再到年底的ESMO IO,披着荣光上市的TLR抗体偶联物公司Bolt和Silverback先后遭遇临床数据滑铁卢,Silverback甚至因此放弃肿瘤方向、裁员并转攻乙肝。反而是Seven&Eight的TLR7/8激动剂在联用免疫检查点抑制剂的研究中以稳健的临床数据守住了阵地。
而2020年提到的其他TLR激动剂开发公司,有的在全年数据与战略更新中缺席了TLR激动剂项目(Nektar和Novartis),有的于管理层更迭中等待新数据(Checkmate)。
偶联技术第一梯队降维打击失败?
Bolt和Silverback平台代表的是抗体-TLR激动剂偶联物技术,该技术把经典ADC里抗体偶联的细胞毒药物替换为TLR激动剂,在肿瘤微环境中先通过特定靶点引发局部免疫反应,同时促进肿瘤清除和免疫记忆的形成。从机制上讲,抗体-TLR激动剂偶联物需要通过:1)肿瘤抗原识别;2)Fcγ受体依赖性吞噬;3)TLR介导激活髓系细胞杀伤肿瘤,随后T细胞介导抗肿瘤作用。
抗体-TLR激动剂偶联物本身相当于几年前业界开展的靶向药和肿瘤免疫药物的联用,差别在于作用位置更精确。当抗体-TLR激动剂偶联物再和PD-1/L1抗体在肿瘤微环境里会师,理论上对肿瘤细胞有更强的杀伤力。
但Bolt的BDC-1001和Silverback的SBT6050于2021年公布的临床数据远不及预期,这两款直接对标的HER2抗体—TLR激动剂偶联物,无论单药还是初步的PD1联用数据,患者都未达到显著的临床缓解效果,两家公司在几十位可评估患者的基数上,均只观察到了一个PR(部分缓解)。如今两家公司的市值都降到了1亿美元左右,各自账上现金也只有3亿美元上下,这意味着他们都已经进入了现金远大于市值的状态。
顺便一提,Bolt的创始人是斯坦福大学的Edgar Engleman教授,他在肿瘤免疫学与髓细胞系生物学多年研究成果体现在了Bolt平台和项目的设计中。由他主导研发的前列腺癌疫苗药物Provenge(Sipulucel-T)被证明可以延长转移性前列腺癌患者的寿命,虽然Provenge上市后销量不佳,却是FDA批准的首个个性化肿瘤免疫治疗方法。
在第一梯队两家公司首战皆败北的局势下,这一全新的药物偶联机制究竟还有没有未来,我们可以来回顾下他们在临床前阶段建立的假设。
他们之所以限定靶点,并煞费苦心设计抗体偶联TLR激动剂,是希望能限定TLR激动剂在肿瘤局部发挥作用。这方面Silverback确实不如Bolt。
在Silverback的 1期临床中,患者血液样本中的游离payload(药物负载)很低,大部分患者都没有检测到。而游离payload的检测结果也许并不能完全解释清楚,为什么Silverback的1期剂量爬升过程很快就遇到了剂量限制性毒性(DLT),包括三级的低血压、输液相关反应、发热、缺氧等。此前Celgene开发过的一个单纯TLR激动剂也出现过低血压的副作用。所以对于Silverback的药物结构设计是否及格,payload是否只在肿瘤微环境中激活,业界都是存疑的。有一种可能是Silverback选择的payload活性过强,和偶联物的其他组分匹配不够默契。相比之下,Bolt的BDC-1001安全性还算过关,没有出现明显的游离TLR激动剂副作用。
Bolt为什么坚守BDC-1001
直接竞争对手Silverback已经放弃肿瘤方向,Bolt对在研的BDC-1001采取什么样的策略?在3月份和投行的交流会中,Bolt的CEO强调,目前有两方面的证据支持这个项目继续推进。
首先,在一部分接受BDC-1001治疗的患者用药前后的活检样本染色里,Bolt观察到了BDC-1001促进髓系细胞、NK细胞和杀伤性T细胞浸润,促进巨噬细胞向M1型转化的直接证据(见图1)。
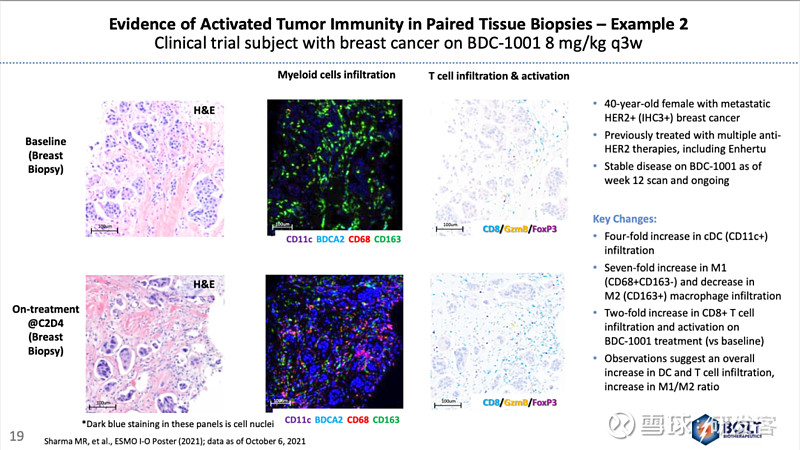
图1
另一方面,患者血液样本内药物浓度监测显示,大部分患者还没有达到临床前阶段预测的、实现治疗效果所需的给药间隔期最低血药浓度(见图2),考虑到BDC-1001半衰期不长,接下来Bolt准备放弃给药便利性,推进每周一次的给药方式以提高最低血药浓度。Bolt认为只有当靶点饱和度达到50-60%左右时,Fcγ受体依赖的ADCP效应才能吸引来足够多的吞噬细胞,BDC-1001结构中的TLR激动剂才有机会开始发挥作用。
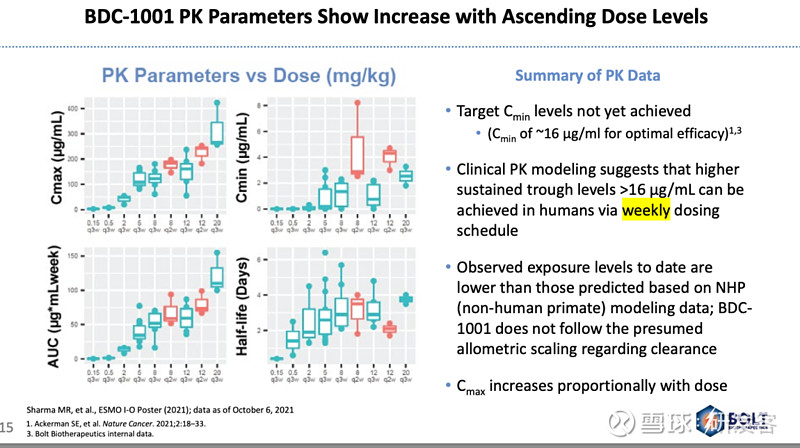
图2
对比之下,药代动力学(PK)方面,Silverback强调观察到SBT6050的血药暴露量随剂量增加而增加,且在几个较高剂量水平下AUC呈现线性变化,而线性PK说明HER2受体介导的血药清除率达到了饱和(见图3),这使得Silverback认为再增加剂量不会有更强的临床效果。当然DLT也是阻碍它继续提高剂量的因素。
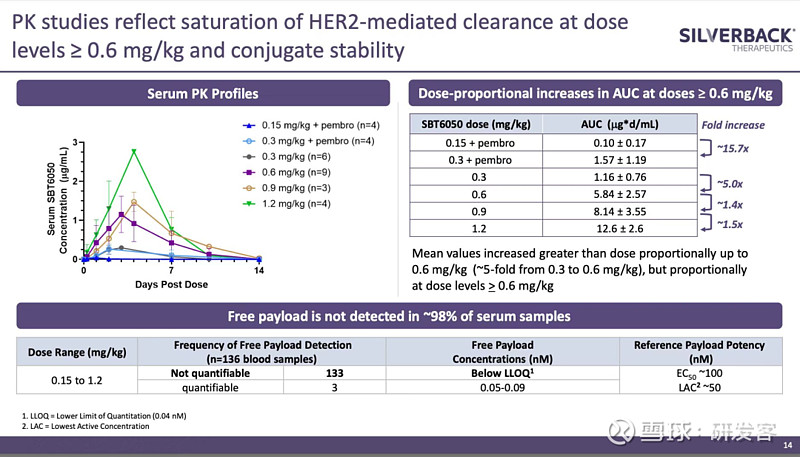
图3
不过,对于开发HER2靶点的小公司,他们从一开始就清楚,这两年HER2领域的竞争极其激烈,Enhertu很可能是今年内的疗效纪录保持者。即使抗体-TLR激动剂偶联物能顺利探索到一定的治疗窗,与其他HER2药物相比差异化在什么方面?
Bolt认为理论上有差异,他们暂时只能以临床前的一些结果作为证据:Bolt团队发现,抗体-TLR激动剂偶联物介导的免疫记忆并不局限于抗体靶向的抗原,他们观察到经抗体-TLR激动剂偶联物治疗后的小鼠可以经受住HER2阴性亲代肿瘤的再挑战[1]。这说明试验小鼠体内T细胞免疫的参与可能促进了抗原表位扩展,从而形成了较长期的免疫记忆,当然这还有待在患者的长期随访中看到直接的证据。
然而新技术公司讲一时的故事容易,距离实现临床验证,BDC-1001还有比较长的路要走。作为IO药物,BDC-101能否在已实现临床获益的患者中找到合适的生物标记物,比如细胞因子、血液生化指标的变化阈值,可能会是锁定目标患者、提高疗效的关键。而到底能否展现免疫激动剂和HER2抗体1+1>2的效果,希望在接下来1~2年内会有答案。
抗体偶联物领域一个新思路
除了Bolt和Silverback,最早以非天然氨基酸偶联技术为特色的公司Ambrx Biopharma也公布了研发管线中的同类药物候选物,现在仍处于临床前研发阶段。(关于Ambrx的技术,参见《Ambrx的非天然氨基酸偶联技术有何特色?》)
而在偶联物领域尝试新机制的一个例子是Sutro Biopharma(天士力生物去年底与Sutro Pharma签订了靶向FRα ADC STRO-002的大中华区权益授权协议)。它在大家都熟悉的抗体偶联细胞毒性药物经典结构上增加了TLR激动剂的偶联(见图4),冠名iADC。
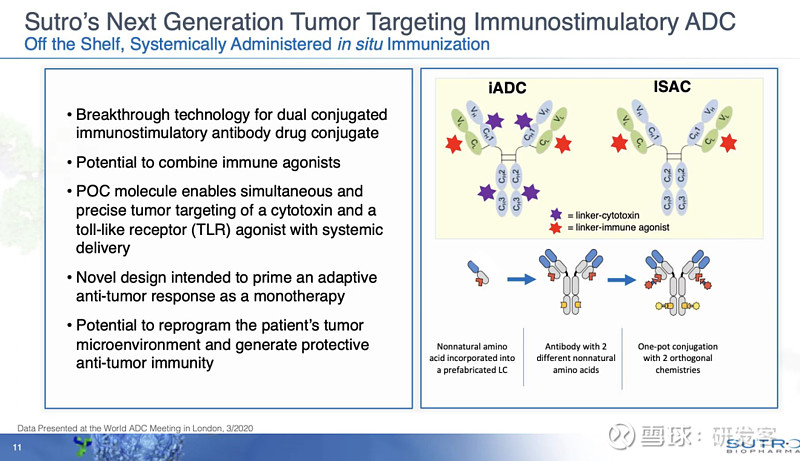
图4
Sutro认为这是对传统ADC和免疫激活型ADC的灵活应用,但我们还看不到临床数据。如果有一天一众ADC公司纷纷转向这个方向,可能他们在经典ADC开发方面know-now的经验能够带来更好的临床应用数据。
TLR激动剂领域:
IO联合初见成效,BioNTech新入局
看过了偶联物技术的纷繁,让我们再来给2020年提到的单纯TLR7/8激动剂做个简短的更新,这个领域只有一款产品BDB001公布了新的数据。
2021年,Seven&Eight研发的BDB001有两次主要的数据更新,分别是ASCO上宣布与pembrolizumab联用数据,以及SITC上初步公布联用atezolizumab的数据。两项研究分别选定了RP2D(临床2期推荐剂量)。总体来说,其不良反应数据中CRS类反应比Bolt和Silverback多(直接应用游离药物的固有问题),但并没有观察到DLT。
在BDB001联用pembrolizumab的研究中,19名可评估患者中,1例CR(经过4线治疗的PD-L1低表达TNBC患者,MSS,低TMB),ORR达26%,在IO/IO联合中不算差。其中4名临床响应患者用药已经超过了18周,1名响应患者很快将迎来第18周的影像评估。这些响应者中除了一名黑色素瘤患者,其他患者多是免疫检查点抑制剂反应不佳的肿瘤类型。个体案例分析中,让人印象深刻的是一位转移性胆管癌患者,从治疗前后的CT图片对比来看,她的肝脏病灶减瘤效果非常明显,她已经应用这个联合方案较长时间。现在,该联用方案已经确定了RP2D剂量并开始了2期的患者招募(NCT04840394)。(见图5、图6)
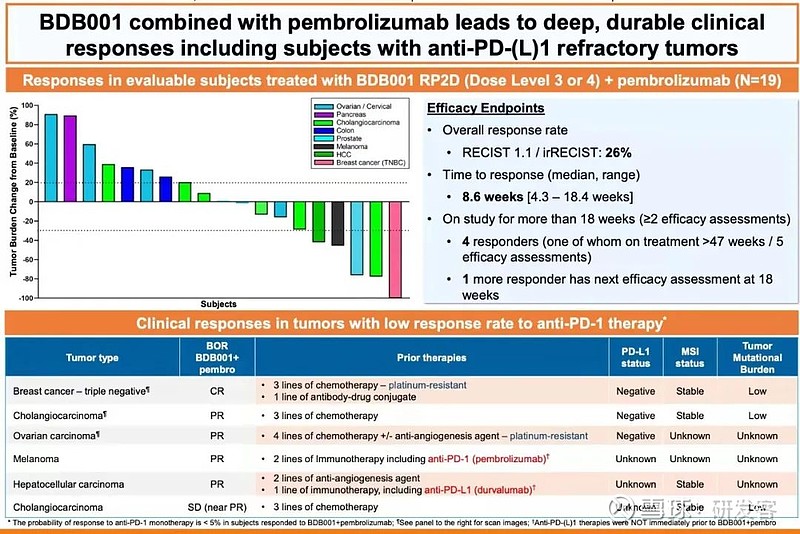 图5
图5
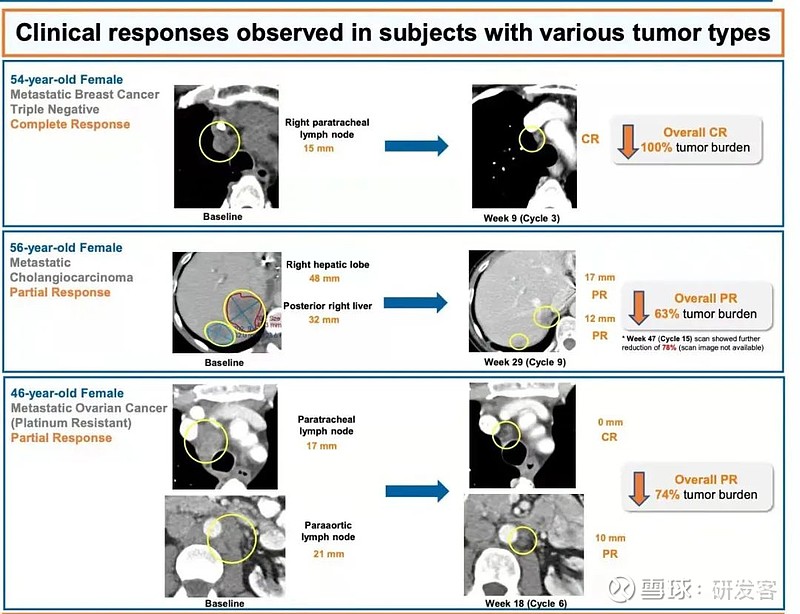
图6
在联用PD1或PDL1抗体治疗晚期肿瘤方面,小公司通常会二选一。但Seven&Eight同步推进了BDB001分别联用两种免疫检查点抑制剂的研究。在较小的1期试验规模下,BDB001与atezolizumab的联用似乎在疾病稳定效果(>18周 PR或SD)、临床稳定持续时间上有较为明确的特点,这延续了BDB001单药的优势。BDB001此前已经证实了可以安全地使用静脉注射剂型,激活患者体内有潜在抗肿瘤价值的pDC细胞。
目前响应较好的肿瘤类型主要是抗PDx已获批的非小细胞肺癌和膀胱癌。Seven&Eight在此基础上推进了研究者启动的2期研究,探索的是针对6个瘤种的BDB001+atezolizumab+放疗的三联方案(NCT03915678),希望在肿瘤免疫循环多管齐下的治疗下,能看到更多的瘤种有患者响应。
Seven&Eight仍然看好抗体偶联TLR激动剂的未来前景,在其研发管线中包含有临床前阶段的TLR7/8激动剂偶联抗体项目,靶点分别是PDL1和HER2。BDB001与atezolizumab联用的初步数据提供了一个起点,而靶向PDL1的TLR激动剂偶联物则属于IO疗法中的新技术路线,如果个中限制问题能够得到克服,Seven&Eight有机会掀开新的篇章。
今年AACR刚刚落幕,其中也有刚入局TLR激动剂的公司——纵深多领域研发的BioNTech公布临床数据。其开发的BNT411也是静脉应用型的TLR7激动剂,目前入组人数较少,能观察到安全性尚可,用药后患者外周血的1型干扰素如IFN-α和IP-10等分泌增加,较高剂量水平下IL-6分泌增加,而TNF-α的分泌则没有显著增加。BioNTech计划在下一次更新中再给出临床疗效的数据。
结语
在等待了一年多时间后,抗体偶联TLR激动剂技术仅带来了Silverback和Bolt首战败北的消息。是惜败还是有底层设计问题,还需要后续研究结果进一步阐释。多数TLR7/8激动剂研发公司在2021年并未更新数据,Seven&Eight的BDB001与PDx联合用药新数据依然延续了2020年的良好势头,纵深多领域研发的BioNTech则成为新入局者。
引文:
[1] Ackerman S E , Pearson C I , Gregorio J D , et al. Immune-stimulating antibody conjugates elicit robust myeloid activation and durable antitumor immunity[J]. Nature Cancer, 2020:1-16.
其他数据来源:各公司官网和投资者关系网站
总第1581期
访问研发客网站可浏览更多文章
