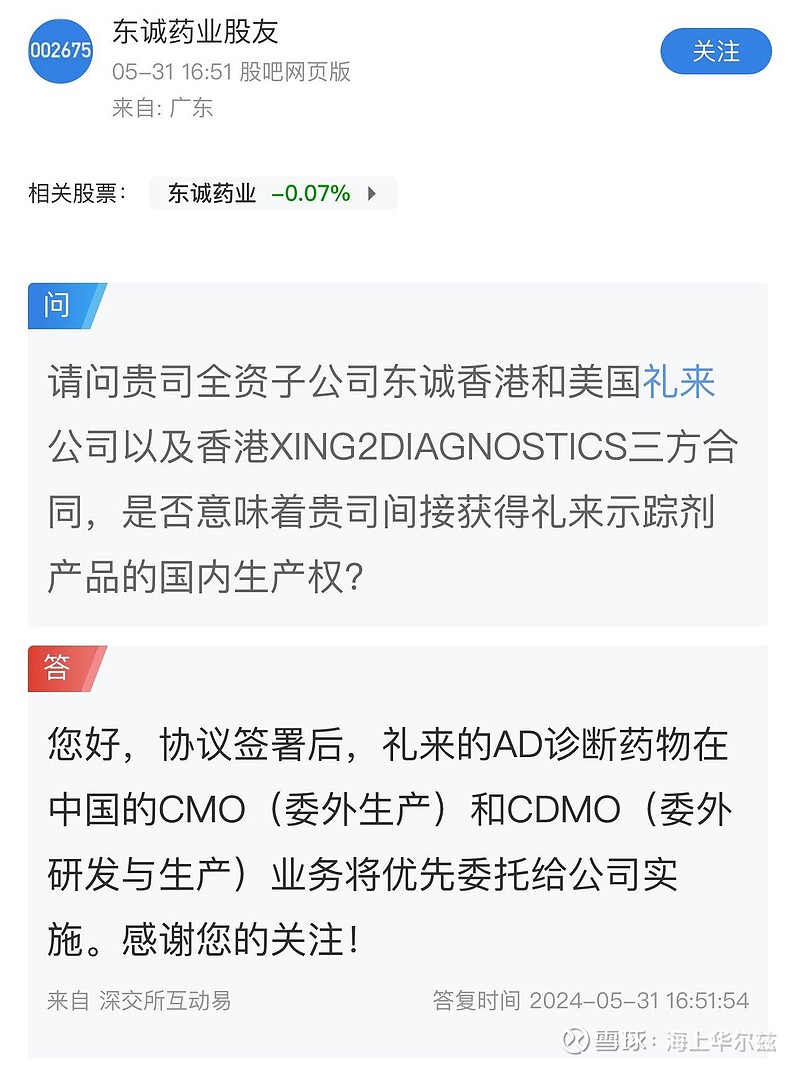
礼来AD阿尔茨海默症药物获批在即,CDMO服务商东诚药业即将受益。
6月10日,FDA外周和中枢神经系统药物咨询委员会(PCNS)就Donanemab用于治疗早期症状性阿尔茨海默病(AD)的生物制品许可申请(BLA)召开的会议结果出炉,委员会以11:0的票数一致赞同该药物的有效性,并一致赞同其获益大于风险。
Donanemab是礼来开发的一款新一代Aβ单抗,可与β淀粉样蛋白亚型N3pG结合,从而促进患者大脑中淀粉样蛋白斑块的清除。
礼来曾在2021年10月基于II期TRAILBLAZER-ALZ研究的数据递交该药物的上市申请,但该申请在2023年1月被FDA拒绝批准。时隔4个月,在顺利完成III期TRAILBLAZER-ALZ 2研究后,礼来再次向FDA递交了Donanemab的上市申请。FDA本应在今年第一季度对该申请作出审批决定,但决定召开委员会会议讨论Donanemab的几个关键问题,因此推迟了审批时间。
问题背景:礼来在TRAILBLAZER-ALZ 2研究中纳入了低/中/高tau蛋白水平的早期症状性AD患者,排除了无法检测到或极低tau蛋白水平的患者;TRAILBLAZER-ALZ 2研究的安全性扩展研究额外纳入了无法检测到或极低tau蛋白水平的患者。结果表明,Donanemab在低/中tau蛋白水平人群中的疗效优于高tau蛋白水平人群;无法检测到或极低tau蛋白水平的患者在接受治疗后也有所获益。
投票结果:11:0投票赞成现有数据可以证明Donanemab治疗早期症状性AD的有效性。
问题背景:在TRAILBLAZER-ALZ 2研究中,Donanemab组患者的iADRS评分下降速度显著延缓,但下降幅度较小;治疗第24周、52周和76周时分别有17%、42%和60%的患者能够停药;仑卡奈单抗目前未考虑过停药方案;3例患者在研究中因ARIA死亡。
投票结果:11:0投票赞成早期症状性AD患者接受Donanemab治疗后的整体获益大于风险。
经此一战,Donanemab有望守得云开见月明。期待FDA的监管决定!
$礼来(LLY)$