今日,国家药监局药品审评中心(CDE)官网显示,浙江特瑞斯药业有限公司申报的注射用TRS005临床申请获得批准。
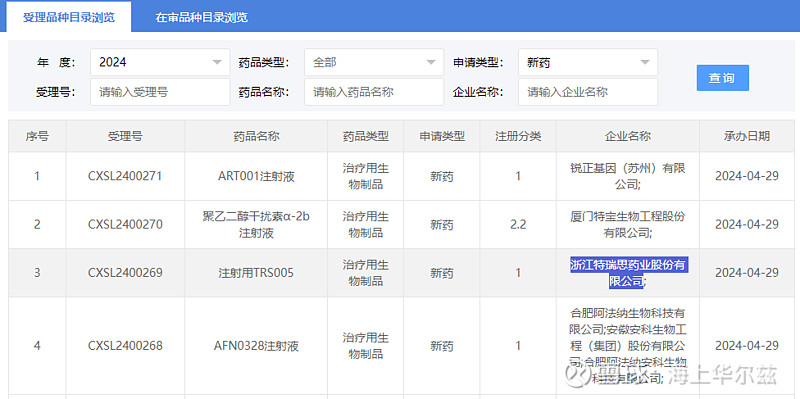
2024年3月18日,国家药监局药品审评中心(CDE)官网显示,由浙江特瑞思药业股份有限公司自主研发的靶向CD20的抗体偶联药物(ADC)注射用TRS005拟纳入突破性治疗品种。此次的适应症为至少经过2次标准治疗的复发或难治性CD20阳性弥漫大B细胞淋巴瘤(DLBCL)患者。

TRS005是特瑞思自主研发的一款拟用于CD20阳性非霍奇金淋巴瘤的创新型抗体偶联药物,靶向CD20+肿瘤细胞,通过受体介导的内吞作用将MMAE(一种剧毒的抗有丝分裂剂)输送到细胞中。目前已获得的临床试验数据显示,在安全性和有效性(主要疗效指标包括ORR、PFS等)方面,TRS005具备优于相关竞品的潜力。
通过企查查查询,浙江特瑞思药业股份有限公司的参股股东是黑龙江珍宝岛药业股份有限公司,持股比例高达17%。