

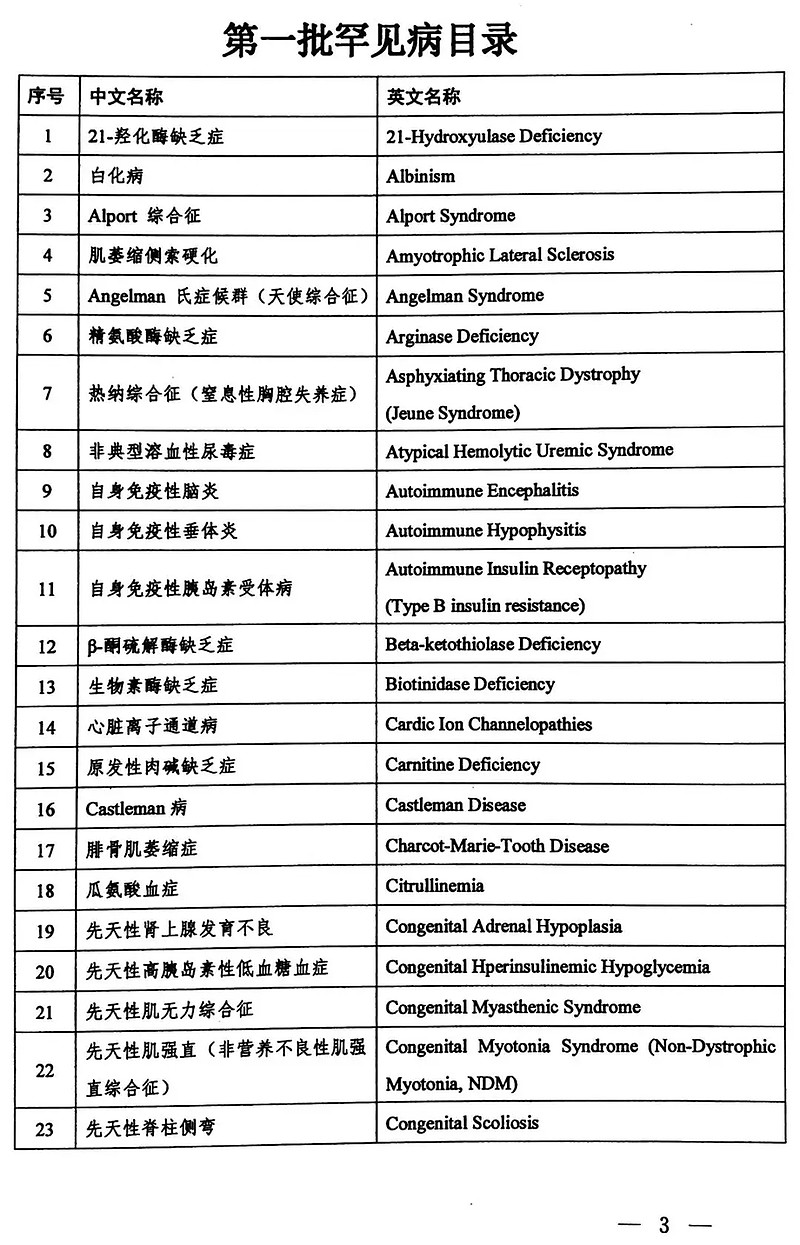
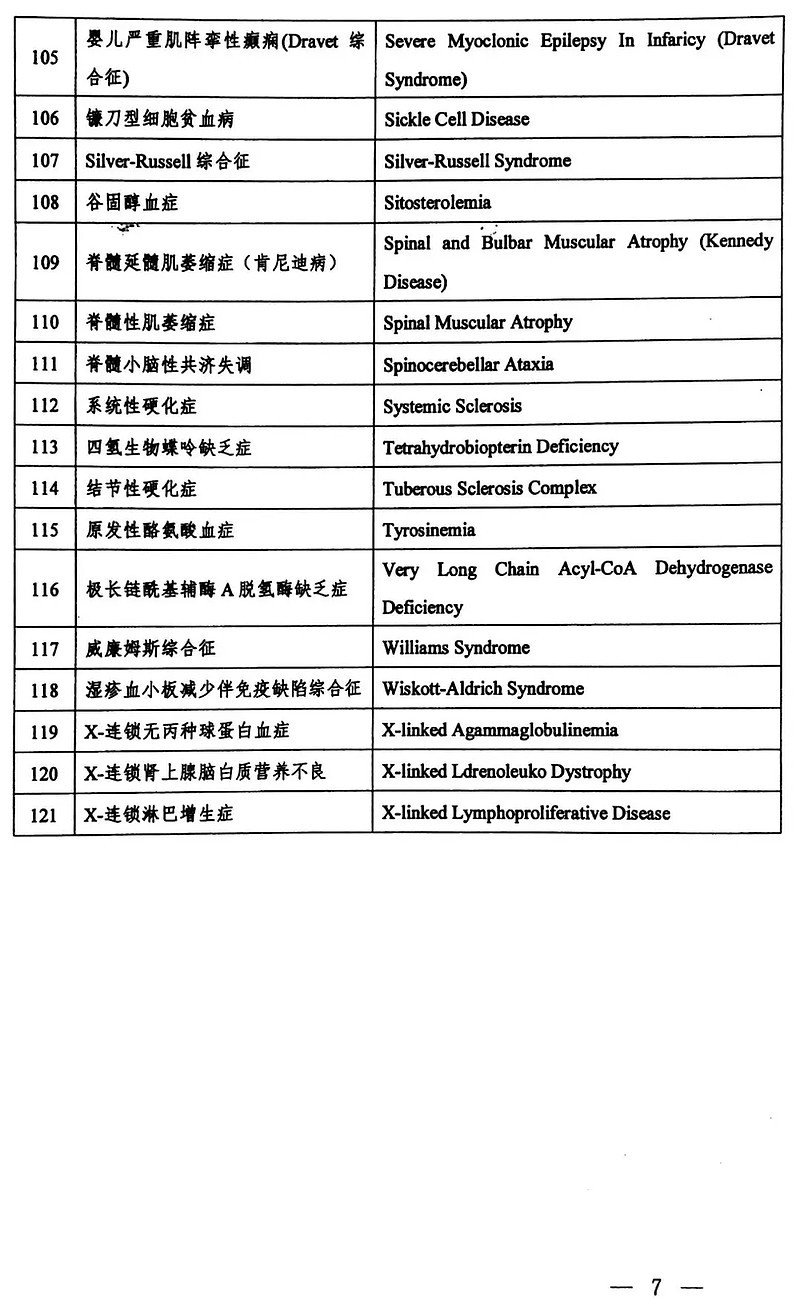
国家版罕见病名录共121种,终于落定啦!国家卫生健康委员会、科学技术部、工业和信息化部、国家药品监督管理局、国家中医药管理局等5部门联合发布。
2016年9月罕见病发展中心(CORD,又称:上海四叶草罕见病家庭关爱中心)发布《中国罕见病参考名录》共计147种疾病,(【快讯】《中国罕见病参考名录》发布,147个病种入围(内附全文))其中有88种疾病与国家版罕见病名录重叠。此次国家版名录的发布是在整个行业多方努力的结果,虽然姗姗来迟但依旧给罕见病患者家庭及罕见病与孤儿药行业带来希望!
各省、自治区、直辖市及新疆生产建设兵团卫生计生委、科技厅(委、局)、工业和信息化主管部门、食品药物监督管理局、中医药管理局:
为贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,加强我国罕见病管理,提高罕见病诊疗水平,维护罕见病患者健康权益,国家卫生健康委员会等5部门联合制定了《第一批罕见病目录》。现印发你们,供各部门在工作中参考使用。






南京应诺医药科技有限责任公司董事长、投壶智库专家郑维义在得知国家五部委发布罕见病目录时激动地说到:“通过各方多年的努力,终于看到首个国家罕见病目录的发布。虽然只有121种,但这是个很好的起步,相信今后会有更多的罕见病会录入到这个目录,而且相关支持罕见病药物研发的具体政策也会出台。期待有关税收支持政策,市场独占,药物定价和支付上有特殊的政策措施。不是有希望才坚持,是因为坚持才有了希望!”
延伸阅读:罕见病扫盲根据美国国立卫生研究院的定义,罕见病是指那些患病人数不足20万的疾病。中华医学会医学遗传学分会也提出,罕见病是指患病率低于1/500000,或者新生儿的发病率低于万分之一的疾病。在过去的几十年间,罕见病一直没有得到医疗领域和社会足够的重视,它们甚至被称作了“孤儿病”。幸运的是,通过立法和呼吁,越来越多的人开始理解到罕见病的重要性。每年2月的最后一天是国际罕见病日,旨在让我们认识到罕见病在当今社会可能造成的影响。
尽管每一种罕见病都只影响了极少的人群,但现在已知的罕见病就有7000多种,全部的罕见病加起来,将有3000万人之众。其中又有将近一半是儿童,而其中的450万儿童会因为罕见病而在5岁前夭折。
许多罕见病人并不知道自己究竟患了什么病。即便确诊后,他们也往往缺乏有效的治疗手段。目前仅有4%罕见病患者可以得到有效的治疗,但对于其他人,他们能得到的最好的医疗仅仅是能够拖延病情,不让病情迅速恶化。对于整个医疗行业来说,它们对患有罕见病的儿童几乎是无能为力的。
目前在罕见病的研究道路上依旧存在着不少阻碍。首先,罕见病病人往往分散在很大的区域中,想要找到足够的病人来进行临床试验就是一个巨大的挑战。其次,由于病情罕见,可查询到的相关的文献极少,让医学专家无从起步,只能自己重新构建知识体系。再次,目前的医药环境鼓励药企将自己的研发视作是专利知识产权受到保护,没有公开专利的动力。最后,也是最重要的,就是企业的逐利属性,让药企放弃更流行、患者数量更多、市场规模更大的病种,投入到如此小的需求市场上,非常不现实。为了解决这些问题,致力于罕见病的专家们呼吁医药行业需要变得更加开源,合作也要变得更为频繁。这种理念的变化无疑会对药物的开发带来益处,我们也相信由于交流不畅带来的重复实验也会因此变少,进一步提高药物研发的效率,降低药物研发的成本。
为鼓励药企研发生产孤儿药(即罕见病药),1983年美国颁布了罕见病相关法案《Orphan Drug Act,ODA》(21 CFR 316),支持鼓励孤儿药的研发与生产,生产孤儿药的企业可以享受7年市场独占期,50%临床研究费用的税务优惠,220万美元的NDA审批费优惠以及研发补助。欧洲EMA于1999年制定法律,一是加快孤儿药上市审批时间,由EMA孤儿药委员会在90天内完成审批;二是罕见病治疗的药物在进行临床试验时可享有一些激励机制,包括援助协议、上市前得到EMA的科学指导、一旦上市可有10年的市场独占期(儿科用药还可再延长两年)。
2017年《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》明确指出,“支持罕见病治疗药品医疗器械研发”,并公布了罕见病目录,建立罕见病患者登记制度。罕见病治疗药品医疗器械注册申请人可提出减免临床试验的申请。对境外已批准上市的罕见病治疗药品医疗器械,可附带条件批准上市,企业应制定风险管控计划,按要求开展研究。此外,《基本医疗卫生与健康促进法(草案)征求意见稿》提到:“建立以临床需求为导向的药品审评审批制度,支持临床急需药品、儿童专科药、罕见病用药、重大疾病防控用药等药品的研发、生产,满足疾病防控和公民多层次、多样化用药需求。”

