$天士力(SH600535)$ t89三期到底什么进展了?看实验计划,24年4月就应该完成了,目前美国的实验已经完成了,反而成都和西藏的实验还在招募中(23年5月更新的信息),理论上早就应该完成了的。不知道结果咋样。。。
天士力T89作为中药FDA冲关的先锋队,还是挺值得关注的,希望最终能够成功!
补充下相关信息:
1. FDA申请流程如下
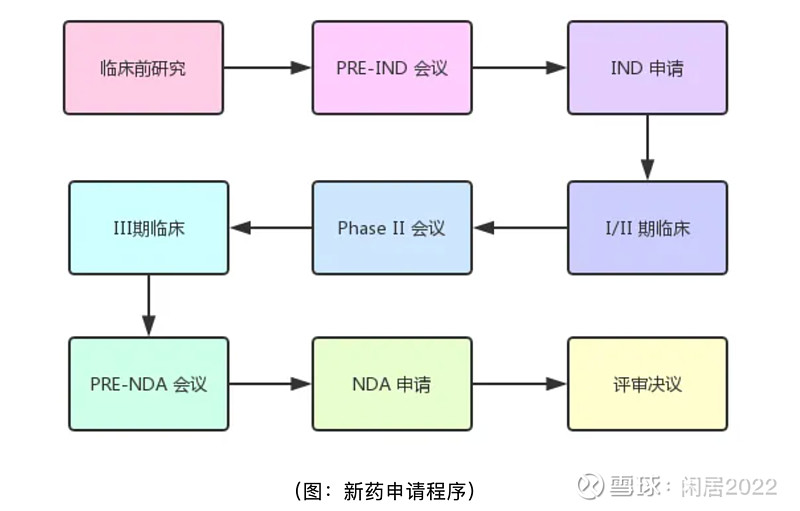
2. 天士力T89的急性高原症试验目前大概率已经结束三期临床试验(预计试验完成时间是24年4月,三个实验中心,一个在美国,两个在中国,美国的去年5月更新的时候已经完成招募了,中国的理论上不应该更慢)
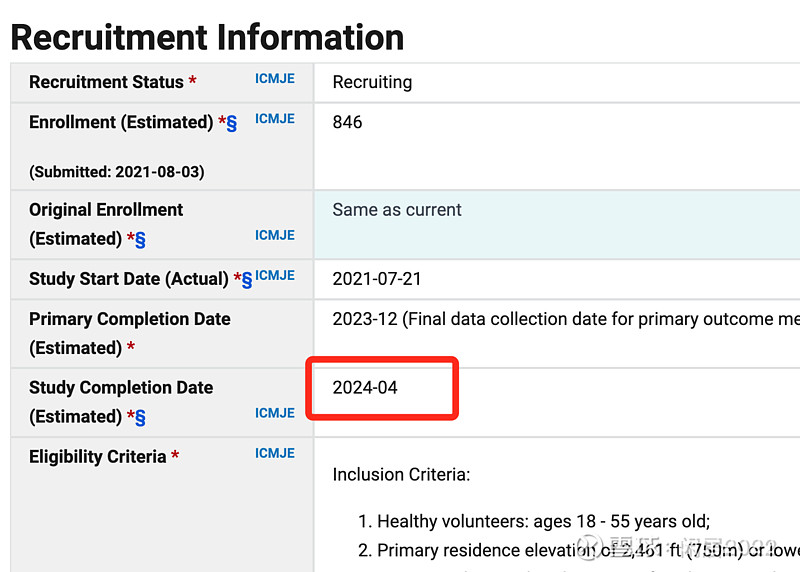
3. 目前的进展在NDA审批阶段,标准审查时间是10个月。

所以,整体预计来看,假如4月份完成实验后立即提交审查材料,预计明年两月份会出审查结果。
全部讨论
说是正在数据统计,孙副董事长领导整理材料,时间无法估计今年天士力对t89很低调,不知道啥原因
国内知名医药上市公司天士力(600535.SH)在美国临床试验注册登记网站上登记了一项T89预防及治疗急性高原反应的III期临床研究。T89为天士力核心品种复方丹参滴丸在美国进行临床研究申报的代码。
这意味着,在努力了20多年“出海”至今无果后,天士力和复方丹参滴丸又在寻找新的打入美国市场的路径。
复方丹参滴丸最新临床试验信息复方丹参滴丸“出海”往事公开资料显示,复方丹参滴丸是天士力独家开发研制的一种主要用于预防和治疗心血管疾病的复方中药,也是天士力的主打产品。天士力2020年财报显示,复方丹参滴丸销售量在1.08亿盒左右,以26元的中标价推算,复方丹参滴丸2020年销售额为28亿。《IQVIA中国医院药品统计报告(>=100床位)》显示,2020年四季度中成药用于缺血性心脏病市场口服用药排名中,复方丹参滴丸排名第一,市场份额为14.6%。
而早在1998年,天士力就开始计划将复方丹参滴丸在美国上市。1998年,复方丹参滴丸以药品身份正式通过美国美国食品药品监督管理局(FDA)的第一次临床研究(IND)申请,并于2006年再次获得FDA的IND批准,确定了预防和治疗慢性稳定性心绞痛的临床适应症,并已完成试验代码为T89-07-CAESA的Ⅲ期临床研究。
在当时,复方丹参滴丸也一度被认为是最有希望在美国获批上市的中成药,但没想到的是,这一“出海”就出了二十多年,至今石沉大海,杳无音信。
根据此前公告和公开报道,在拿到了IND批准后,天士力向FDA递交了复方丹参滴丸治疗慢性稳定性心绞痛的新药申请的相关审批资料。但是,虽然复方丹参滴丸在II期研究达到主要终点,但是在III期研究中未达到与II期研究设定相同的主要终点,2017年8月,天士力发布公告称,根据FDA意见,天士力需最后增补一个6周统计显著的验证性临床实验,作为新药批准的依据。
2018年12月,天士力再度发布公告称,其将按照FDA要求,在美国地区启动一项多中心、双盲、随机对照的临床试验,再次验证T89治疗慢性稳定性心绞痛的有效性和安全性,以满足FDA对T89治疗该适应症的新药申报的要求。
虽然漫长的“出海”之路还没走到终点,但在这20多年间,关于复方丹参滴丸的质疑声却从未间断。
谢谢贴主 我也确认了一下 确实如此 国内部分耽误我知道是因为那几年的的公共卫生事件。按照这个开始到结束 估计还是要拖一阵子的
谁告诉你的试验完成了,你自己不看财报就开始打胡乱说,财报写得很清楚27年出结果


