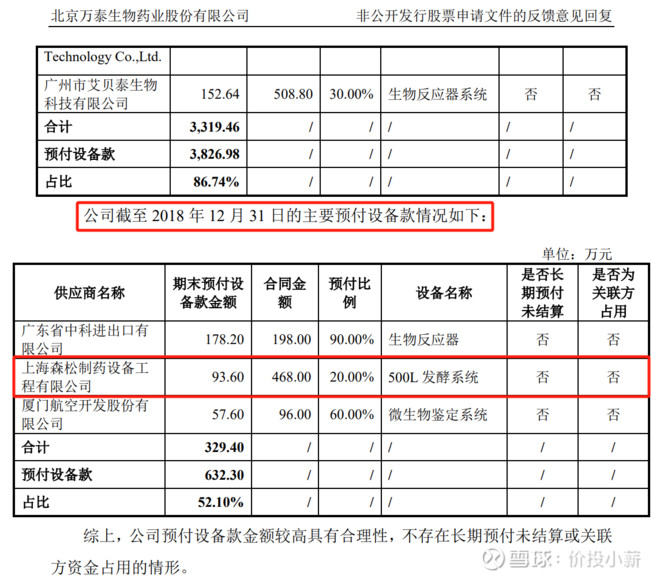
根据这个环评材料和产能核算可以看到,“小试阶段60L发酵罐产能g/批”,且产能是6000万剂,所以不会是2价疫苗的产能表(2价是3000万产能)。我查到的有是2次预付款记录,一次是买了500L的发酵罐,预付款时间18年12月。还有一次是21年9月,合同内容为配液罐系统、CIP/SIP 站系统,合同金额932万。这个金额没超2倍,配液罐系统应该也是这个500L的发酵罐。在18-21年之间没有涉及工艺放大技术,所以应该也是同一个系统。那么是不是可以推断出一期就是用的60L的工艺,搭配500L的发酵罐呢? (每个生产线2个发酵罐,共1000L产能。)
如果这条成立,那么万泰应该就不会因为工艺放大实验而延期了?
写到这里,突然之前想到之前的报道:“近日,粮食发酵与食品生物制造国家工程研究中心白仲虎教授团队通过不懈努力,在较短的时间内将万泰9价HPV疫苗的9个抗原蛋白的表达量从平均100mg/L,提高到了平均500mg/L以上,并且完全采用植物来源的培养基,避免了原工艺使用动物源的培养基导致的产品质量问题”。如果万泰9价二期产线要采用植物作为培养基(变更培养基),那做原工艺的放大对照实验也就说得通了。
(我把前后逻辑都梳理一下,不对的地方欢迎指正,有点啰嗦请见谅。主要贡献来自@黑白郎君南宫恨 @吃土喝茶 @赤焰弓骑 所提供的资料和思路)