
背景介绍
系统性红斑狼疮(SLE)是一种具有很强异质性的自身免疫性疾病。患者体内产生大量自身抗体,可伴有肾脏、心脏、肺、血液、神经等多个器官和系统受累。肾是最常见的损伤器官,狼疮肾炎(LN)占SLE病人的60%。SLE病情易反复,病程较长。多发于15-45岁的育龄女性,女性发病率约是男性的10倍。中国发病率较高约为万分之七,高于全球发病率。目前中国患者有超过一百万人。
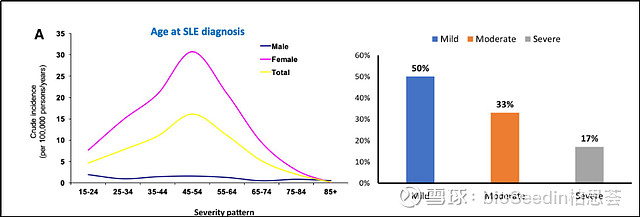
引自:Update οn the diagnosis and management of systemic lupus erythematosus
典型症状是面部出现类似蝴蝶的红斑。之所以会叫“狼疮”是因为早在18世纪,人们认为SLE的面部红斑好像被狼咬伤所致。在临床上,常将红斑狼疮分为两种:病变仅限于皮肤者称为盘状红斑狼疮;有内脏多器官、多系统受累的则称为系统性红斑狼疮。持久不愈的盘状红斑狼疮有可能发展为系统性红斑狼疮肾病。而系统性红斑狼疮肾病病人,可能出现盘状狼疮样的皮疹,也可能不存在皮肤损害。
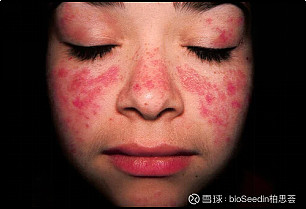
图片来自网络
该病目前无根治方法,最大的风险是感染。经过半个世纪的努力,10年生存率90%以上。SLE已由既往的急性、高致死性疾病转为慢性、可控性疾病。相对于肿瘤疾病,预后患者生命风险较小。目前的治疗手段主要是缓解疾病的进展以及组织和改善对脏器的损害。疾病严重程度、治疗方案及药物是影响SLE预后的关键因素。不断开发新药物,降低副作用仍然是SLE病人提高患者的长期生存率及生活质量的关键。本文将就目前已知的SLE病因和发病机制以及基于此机制上的治疗进展进行详细阐述。

发病原因
SLE病因及发病机制尚未完全明确。目前认为,其是由环境、病毒、药物、激素等刺激因素与多基因相互作用引起免疫系统异常而发生。上述病因,导致机体失去对内源性核抗原的耐受性而引发针对不同组织的异常自身免疫反应而引起的自身免疫疾病。中间T、B、DC以及中性粒等细胞功能异常,如Th1/Th2平衡打破,B细胞过度活跃,机体产生抗体,最终导致疾病的发生。目前治疗药物包括激素、免疫抑制剂以及生物制剂主要是维持TB细胞免疫的紊乱。

图片来自网络

发病机理
在过去的几十年里,超过100个与SLE和LN相关的易感基因位点被确定。可能参与SLE发病机制的基因可大致分为四类:参与淋巴细胞功能的基因、参与先天免疫信号传导的基因、参与DNA清除和补体通路的基因以及导致肾脏损伤的基因。比如最经典的是参与抗原处理和呈递的HLA位点的变异。在LN中,HLA-DR3和HLA-DR15等位基因与疾病发展风险增加相关,而HLA-DR4和HLA-DR11似乎预示着保护作用。
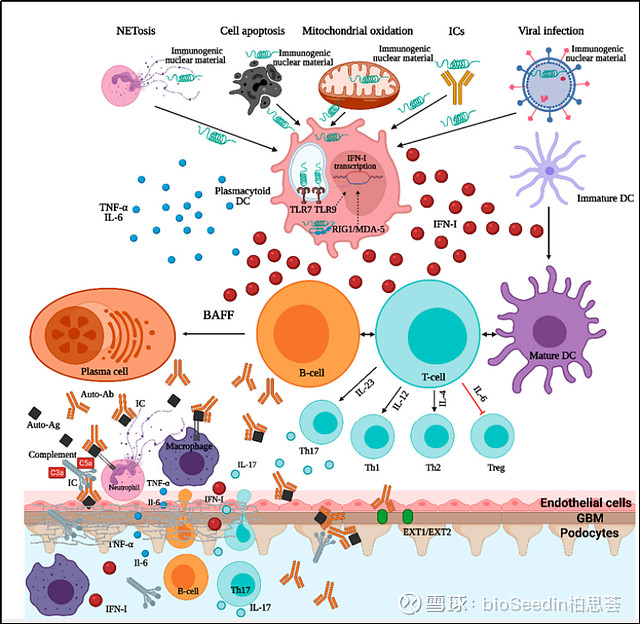
来源:Advances in Lupus Nephritis Pathogenesis: From Bench to Bedside
具有免疫原性的DNA和RNA,通过BCR和FcγRII激活B细胞,通过FcγRII激活未成熟的树突状细胞,进一步激活若干细胞内通路(包括NF-κB,干扰素调节因子IRF5和IRF7),从而提高细胞存活率,促进促炎因子和I型干扰素的产生,以及最终自身抗体的合成。此外,核自身抗原可以通过免疫复合物的内吞作用激活TLR7-9, TLR7-9会招募多个转录通路,如NF-κB、IRF5和IRF7,从而增加细胞因子的产生。除了DNA和RNA内体传感器外, RIG1/MDA-5和cGAS-STING等胞质传感器也起到重要的传导作用。通过I型IFN(干扰素)受体(IFNα RII)信号转导是SLE和LN的一个分子标志。此外,T细胞在SLE发病机制中有几个重要的作用,特别是T滤泡辅助细胞,它刺激B细胞自身反应性和自身抗体的产生。也有文章产生IL-17的T辅助细胞(Th17细胞),是LN的重要驱动因素。总的来说,这些相关基因异常是SLE细胞因子特征环境产生的重要贡献者,包括I型干扰素、B细胞生存因子(BAFF)和几种白细胞介素(IL-6、IL-12、IL-17、IL-23)等所有潜在治疗靶点的介质。
参与DNA清除和补体系统活性的基因是SLE和LN发病机制的重要成分。特别是,编码DNase I、DNase III、DNase-γ参与DNA清除的基因,或编码C1q/C4补体因子的基因被显示与SLE的发展显著相关。中性粒细胞通过一种特定形式的细胞死亡(NETosis)在SLE发病机制中发挥关键作用,其中包含染色质的中性粒细胞胞外陷阱(NETs)释放。缺乏参与中性粒细胞胞外陷阱(NETs)降解的DNAase I和C1q (NETs调理和清除所必需的)的患者,有能够维持自身免疫的核自身抗原的持续来源,不断地刺激机体产生自身抗体。结合形成免疫复合物后,沉积在皮肤、关节、小血管、肾小球等部位,在补体的参与下,引起急慢性炎症及 组织坏死(如LN),或抗体直接与组织细胞抗原作用,引起细胞破坏(如溶血性贫血、淋巴细胞减 少症和血小板减少症),从而引起机体的多系统损害。之所以会造成不同程度的损伤,越来越多的人认为,不同的抗原导致的临床和组织表型是不一样的。

疾病进程阶段
《2020中国系统性红斑狼疮诊疗指南》推荐使用2012年国际狼疮研究临床协作组(SLICC)或2019年EULAR/ACR制定的SLE分类标准对疑似SLE者进行诊断。总分≥10可分类为SLE。
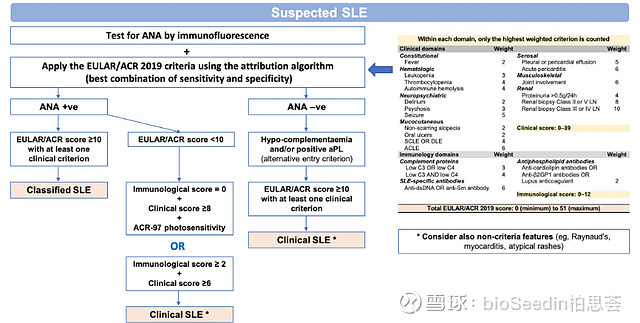
引自:Update οn the diagnosis and management of systemic lupus erythematosus
中国类似的具体标准见下图:
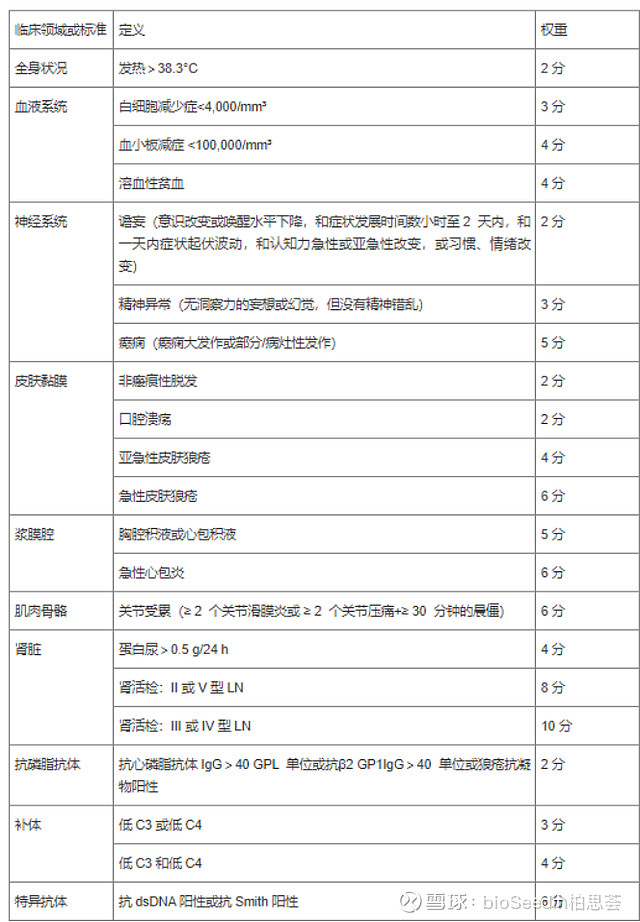
EULAR/ACR 标准2019
对初诊和随访的SLE患者,建议选择SLE疾病活动指数(SLEDAI-2000)评分标准,并结合临床医师的综合判断进行疾病活动度评估;基于SLEDAI-2000评分标准,可将疾病活动分为轻度活动(SLEDAI-2000≤6)、中度活动(SLEDAI-2000 7~12)和重度活动(SLEDAI-2000>12)。SLEDAI积分对SLE病情的判断:0~4分基本无活动;5~9分轻度活动;10~14分中度活动;≥15分 重度活动。不同的评分,决定着的不同剂量激素的使用和不同免疫抑制剂的选择。
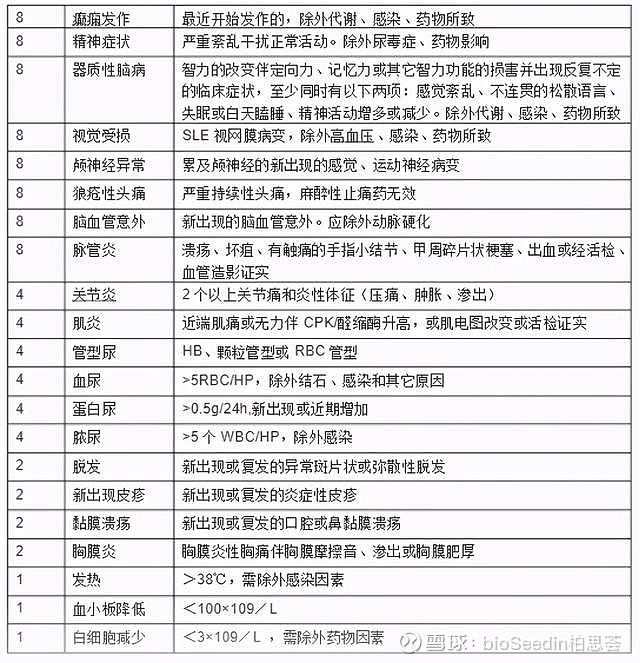
SLEDAI--2000评分表

治病方案
目前,EULAR建议SLΕ的治疗药物,治疗策略,治疗目标和辅助治疗:
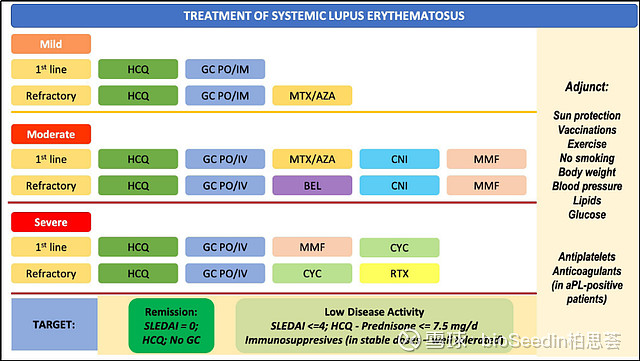
aPL,抗磷脂抗体; AZA,咪唑硫嘌呤; Bel,贝利尤单抗; CNI,钙调磷酸酶抑制剂; CYC,环磷酰胺; GC,糖皮质激素; HCQ,羟氯喹;MMF,霉酚酸酯; RTX, 利妥昔单抗;
引自:Update οn the diagnosis and management of systemic lupus erythematosus
指南给出的诊疗路径:
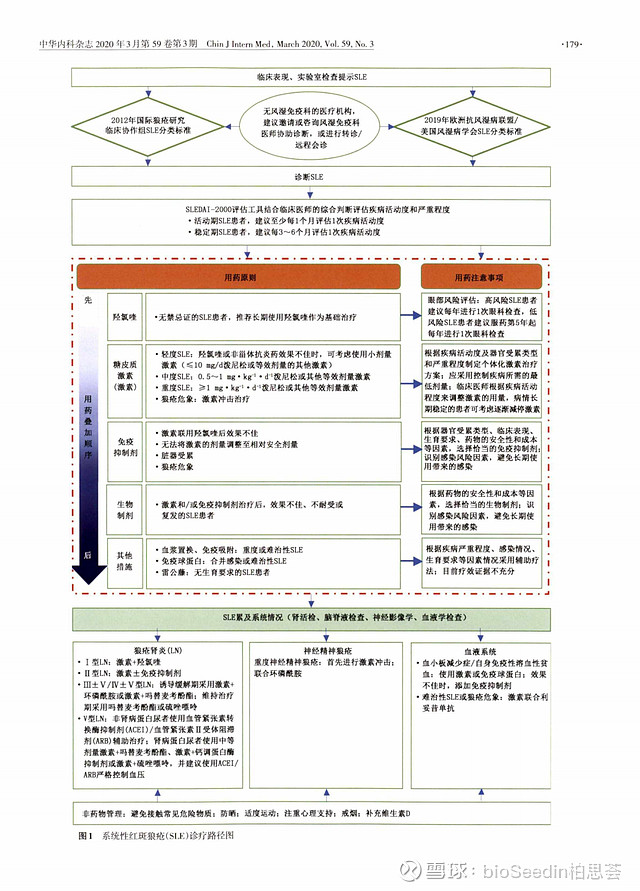
激素在治疗SLE中发挥着至关重要的作用,是SLE诱导缓解治疗最常用且国内外指南一致推荐的控制SLE病情的基础药物。对SLE患者,应根据疾病活动度及受累器官的类型和严重程度制定个体化的激素治疗方案,并应根据病情活动度 、用药时间长短,以及激素的不良反应等情况来调整用药剂量与用法。轻度活动的SLE患者,一般不需要采用激素治疗,中度活动的SLE患者,推荐使用中等剂量的激素泼尼松或等效剂量的其他激素进行治疗。重度活动的SLE患者,推荐使用标准剂量的激素联合免疫抑制剂进行治疗,待病情稳定后调整激素用量。同时,对病情严重的SLE患者 ,必要时可使用激素冲击治疗。
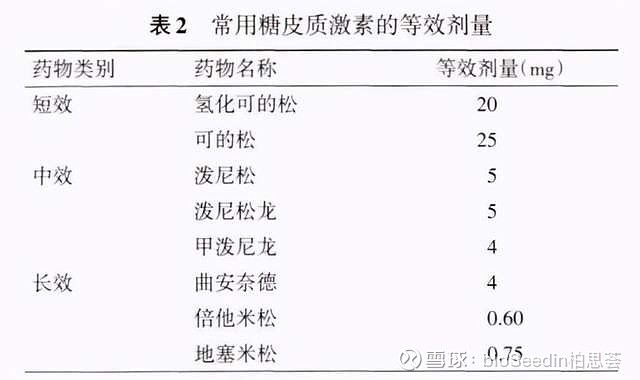
引自:《2020中国系统性红斑狼疮诊疗指南》
副作用不容忽视:
长期服用羟氯喹者,5年后可观察到羟氯喹导致的视网膜病变,而一些高风险人群(长期服用和/或使用高剂量的羟氯喹、伴有肝肾疾病、同时使用他莫昔芬、有视网膜或黄斑疾病史、高龄等)更易诱发视网膜病变。除了羟氯喹,很多治疗SLE的药物都有副作用。

即使贝利尤单抗也不例外,常见不良反应为感染、头痛和恶心。当然相比化药,这些副作用已经很小了。

经典的B细胞疗法
全球只有两个已上市的针对开发治疗SLE或LN的的生物药,分别是Belimumab(GSK)和泰它西普(Telitacicept)。Belimumab是唯一在FDA和CDE都批准的新药;泰它西普目前只有CDE批准,用于8分以上的SLE病人的治疗。实际上泰它西普是比较有意思的。本身作为Atacicept快速跟随开发的药物,竟然后来居上。Atacicept是同样靶向BLyS和APRIL的融合蛋白药物,临床试验中只有试验组(150mg剂量组)出现2例因感染而死亡的受试者。这提示由于SLE有强异质性,在临床试验筛选入组时需要慎之又慎。Rituximab是靶向CD20的生物药,虽然作为B细胞的靶向药,但最初并不是将SLE作为适应症的。对难治性SLE患者在激素和免疫抑制剂单药或联合用药疗效不佳的情况下,联合Rituximab用药可明显改善60~80%的临床症状。也证明了B细胞在SLE中的重要性。
对于这些药物,我们都知道他们是通过靶向B细胞的增殖活化等实现自身抗体的产生来降低疾病的进展。B 细胞清除疗法也是很多自身免疫病的治疗方向首选。Jennifer L. Gommerman和他的团队对针对这种机制开发的药物进行了总结。除了针对常见B细胞靶点的单抗开发,还有安进的BAFF/ICOSL双抗的开发。目前针对SLE的适应症临床已经走到了二期。
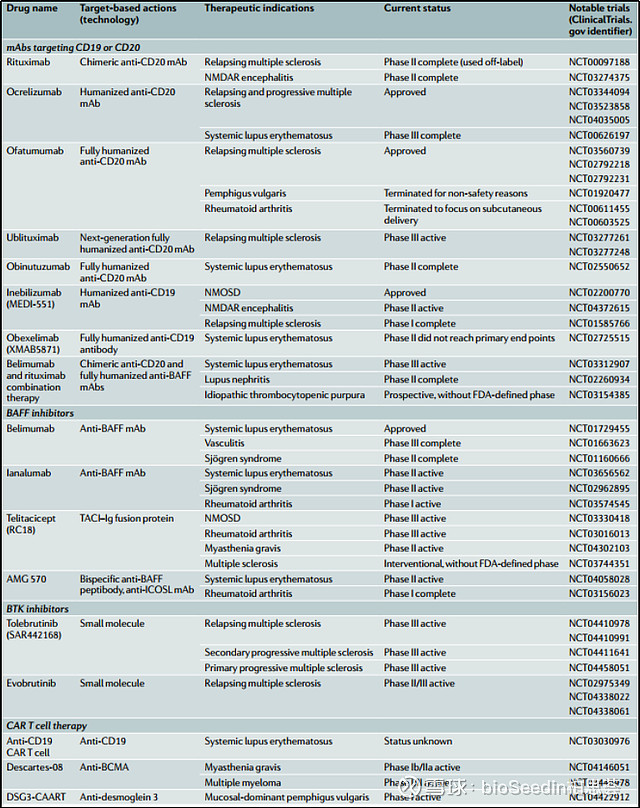
引自:B cell depletion therapies in autoimmune disease: advances and mechanistic insights

其他疗法
除了这些靶向B细胞的药物开发,还有大量的针对不同靶点/机制路径的候选新药正在临床试验阶段:
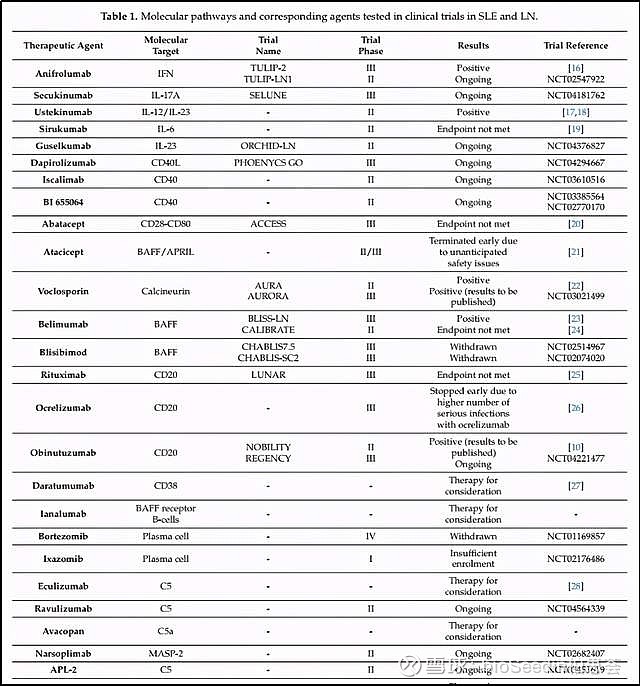
来源:Advances in Lupus Nephritis Pathogenesis: From Bench to Bedside
这些候选药物靶向SLE发病过程中的不同组分,总结在下图:
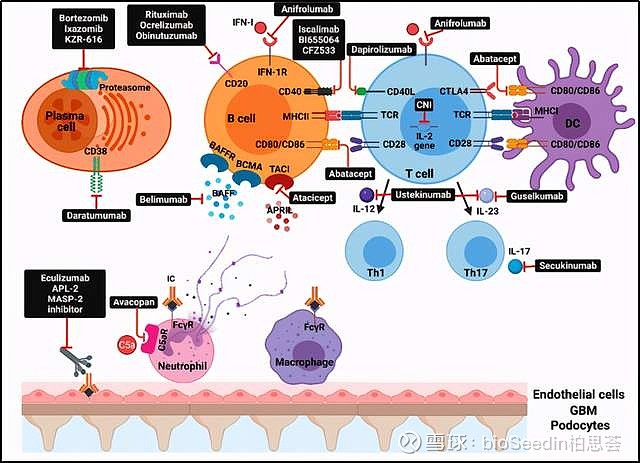
来源:Advances in Lupus Nephritis Pathogenesis: From Bench to Bedside

小结
总之,这些对 SLE 和 LN 遗传和分子基础的最新见解为为这些患者开发新疗法铺平了道路。除了这种疾病发病机制的“传统”以 B 细胞为中心的观点外,了解多种肾外和肾内途径导致肾脏特异性自身免疫和损伤可能有助于完善此类患者的个体治疗和预后特征。
考虑到SLE本身发病机制的异质性和复杂性,想靠一种抗体来彻底治疗甚至是治愈是不太可能的。我们需要进一步开发合理的组合疗法的方案,才能给病人带来更高的收益,提高生活质量。