“未来,属于可以看到它的人”
“抬头看世界,埋头创未来”
关于高瓴峰会上Allogene和传奇生物的CART产品数据的梳理与更新…
这几天是高瓴健康峰会,有很多很有意思的报告。上午11点后听了的《细胞治疗前沿及进展》分论坛,David Chang(Allogene联合创始人兼CEO)、范晓虎(传奇生物联合创始人兼首席科学官)、周剑锋(华科同济医学院附属同济医院血液科主任)、潘静(高博医学研究中心儿童血液病学科带头人)。两个药企代表和两个医生代表,除了潘静不熟,其他仨都是大有来头:David Chang看上去是个华裔,和Arie Belldegrun原来是Kite核心高管,在把Kite卖给吉利德后,转手又联手创立了专注做同种异体CART的Allogene(ALLO.O),迅速实现纳斯达克上市,已经50亿美元+,转眼“又是一条好汉”;范晓虎是港股金斯瑞生物旗下设计多表位BCMA CART的核心科学家,在金斯瑞还是10多亿港币的默默无闻小辈的时候,谁也不知道范晓虎是谁,但在金斯瑞2年涨了30倍之后,范晓虎和他的“传奇”似乎一夜之间真成了“传奇”,平时相对低调,今天终于看到“范博士”本尊;华中科技大学附属同济医院的周剑锋团队是中国CART领域应用的头部专家,信达生物和驯鹿合作开发的BCMA CART就是在同济医院做的临床。
Allogene和传奇生物给出和更新的数据,不得不说是真心强劲(用范晓虎的词叫“让人惊掉下巴”的数据)。
一、Allogene的同种异体CART(通用型CART)
以产品ALL-501为例,同种异体治疗潜力的实现,主要依赖两个设计思路:
1. 用TALEN(CRISPR之前的一种基因编辑方法)编辑敲除T细胞受体a(TCRa)——我们给宿主输入外部来源的T细胞,新输入的细胞会把宿主细胞当成异物进行攻击,这会造成一种叫移植物抗宿主病(GvHD)的疾病,这是给患者输注异体CART进行治疗的最大风险所在,GvHD靠TCR来介导,原则上说只要我们敲除了TCR就可以避免GvHD,这个基本是所有通用型CART的共性基础。
2. 用TALEN编辑敲除细胞膜上的CD52蛋白——CD52在淋巴细胞、单核细胞及很多造血系统细胞表面广泛分布,因此可以用CD52单抗来清除淋巴细胞,Allogene为此专门开发了自己的靶向CD52的单抗ALLO-647来进行CART治疗前的淋巴细胞清除。淋巴细胞清除有助于输入的CART细胞的扩增和生存,Allogene之前的研究也证明了,在给CART给药前用靶向CD52单抗清除淋巴细胞,对CART疗效有着关键影响;但这里的一个问题是,仅是敲除TCR制备的CART细胞也会有CD52,也会被ALLO-647攻击,因此需要敲除CD52后才能与ALLO-647配合使用。
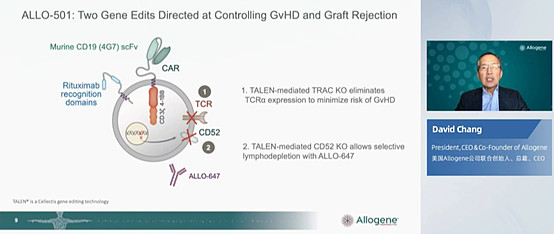
除此之外,如上图所示,ALLO-501的CAR的胞内端有CD3ζ和4-1BB作为共刺激结构域,这个是第二代CART比较常规的设计。另外,ALLO-501还引入了两个利妥昔单抗识别结构域,允许必要的时候用利妥昔单抗来破坏CART,不过很多非霍奇金淋巴瘤都需要先用利妥昔单抗治疗,这会干扰ALLO-501的疗效,因此在后续迭代升级的ALLO-501A中删除了利妥昔单抗结构域。
可以看到,ALLO-501的核心诉求,是希望解决第一代自体CART复杂、冗杂、昂贵的个性化制备问题;核心思路,是通过“CD52单抗处理 + 敲除TCRα”来去除GvHD风险,同时改善体外扩增和生存。那在临床中的真实效果如何呢?
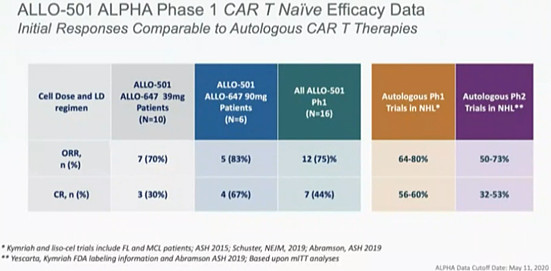
首先,看一下ALLO-501的效果。下图是david chang在会议中提供的ALPHA的1期研究的有效性数据:在之前的自体CART产品Kymriah和Liso-cel治疗非霍奇金淋巴瘤NHL的1期研究中,客观缓解率ORR=[64%, 80%],完全缓解率CR=[56%, 60%]。而ALLO-501在90mg ALLO-647的亚组中,ORR=83%,CR=67%。可以看到,Allogene的同种异体CART的疗效与已经被验证的第一代自体的CD19 CART的疗效相仿可比。
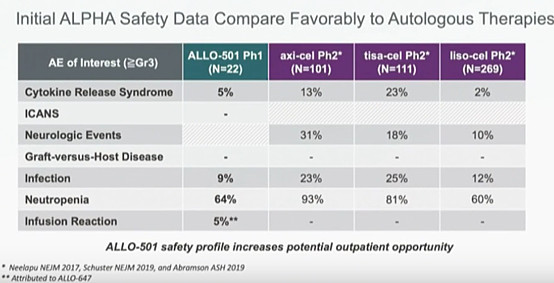
然后,看一下ALLO-501的安全性。下图是david chang在会议中提供的ALPHA的1期研究的安全性数据:在>=3级的不良反应中,ALLO-501有小比例的infusion reaction(输液反应),不过在infection(感染)和cytokine release syndrome(细胞因子风暴)上有更好表现,而在神经事件上则是极大改善。
在疗效相当、安全性更优的基础上,ALLO-501作为同种异体CART,未来大概率会形成对于原来的自体CART降维攻击的优势:a、自体CART每次都需要提取患者的T细胞进行个性化的制备,这里的制备过程漫长,增加患者在等待过程中疾病进展的风险;而异体CART可以用现成的产品,可以极大缩短等待时间;b、而且很多晚期患者自身状况太差,部分患者面临CART制备失败的风险;而异体CART几乎是100%成功,减少了制备失败风险;c、自体CART因为每位患者都要个性化制备,制备成本居高不下;而异体CART可以一次制备大量患者共用,有了规模效应就有了大大降低成本的可能。

“疗效相当”+“安全性更好”+“便利性和成本上有碾压优势潜力”,至少对于CD19靶点,ALLO-501已经让我们看到了明确的迭代预期——或者通俗点说,CD19等八点多额CART产业正在进入以通用化为特征的“2.0”阶段。
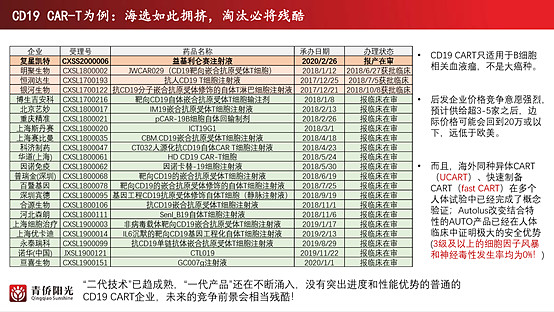
从ALLO-501已披露数据看,这里的升级替代在几年后应该是不可避免的趋势。这是个值得注意的趋势。下图是我们之前路演中探讨国内当下的“创新焦虑”和“创新泡沫”中展示的一张PPT。在拥有“碾压优势”二代产品技术已经成熟的当下,CD19靶点的“一代CART”仍在不断涌入,形成一个非常刺眼的存在——说的好听点,这些产品的竞争会非常激烈;说的不好听点,这里的绝大多数产品尚未出生已经走向“死亡”;可能也就进度最领先的几家能分享这里的红利,而且就算是最领先的产品,也未必适合给太高的远端预期。
CART的研发方向,除了“更快、更安全、更通用、更低成本”之外,另一个很大的思路,是应用场景的不断拓展。由于靶点和渗透等问题,目前已经广泛证明的还只有血液瘤,不过学界和业界对实体瘤的探索越来越多,已经有不少CART已经证明了针对实体瘤的初步疗效,只不过疗效还做不到血液瘤CART般的颠覆。按david chang给的预期,Allogene治疗RCC(肾细胞癌)的ALLO-316预计今年晚些时候申请IND,后来治疗SCLC(小细胞肺癌)的DLL3是值得兴奋的研究。

当然,如果我们可以看得再远一点,CART能治疗的不会仅是肿瘤,细胞疗法也不仅仅是CART。CART的原理,是用基因工程(CAR)去改造细胞工程获得的细胞(T),对现在的生物工程手段而言,这里的细胞工程很可能还会局限在对血液系统可分离细胞的基因改造。但仅就这点而言,便已经意味着非常广阔的产业空间:1. 首先,除了靶向肿瘤相关抗原,我们也可以让CART靶向其它靶点,用CART来治疗感染和自身免疫等疾病;2. 其次,我们不仅可以改造T细胞制成CART或TCRT,我们也可以改造巨噬细胞、NK细胞、红细胞等等,从而实现更多全新的功能。
二、传奇生物的多表位BCMA CART
前几天,朋友圈有一个刷屏的新闻:药品审评中心(CDE)在8月5日首度更新了“拟突破性疗法”,传奇生物的LCAR-B38M有望成为中国首个“突破性疗法”认定。“突破性疗法”审评通道是在7月刚刚从优先审评中分离设立的全新的审评通道,非常明显是在“抄”FDA的作业。事实上,2015年以来的中国药监药审改革,一定程度上核心基本是“全抄”FDA;“突破性疗法”通道是抄的最新的作业——美国2012年设立的“突破性疗法”(BTD)认定通道,2012-2019年共计授予约340项疗法,其中150项已经获批上市,获得BTD的产品可以获得多项扶持政策,一定程度上加速了美国生物医药颠覆创新的发展。
CDE设立BTD通道,我们的理解,是国家推动中国医药创新由“me-too”向“me-better”推进的意愿与决心的体现——在中美关系不确定风险不断增大,国家有意创建“内部大循环”之际,鼓励自主前沿颠覆创新显得非常有意义。
我们理解没错的话,中国创新药“me-too”的价值洪峰已经开始退潮,后面我们会看到非常显著的向“me-better”迁徙的趋势。这里所谓的“me-better”,通俗点说就是要有真正的国际竞争力,典型的比如百济的BTK抑制剂、PD1单抗,比如传奇的CART等。
相比创业即“高配”的百济神州,传奇生物创业初期即没著名科学家、也没产业大资本,然后在2017年ASCO上以惊艳的数据一夜成名,2018年获得强生的巨资投资合作,并且在强生主导的后续临床中表现出了非常强劲的数据,整个过程确实是够“传奇”。
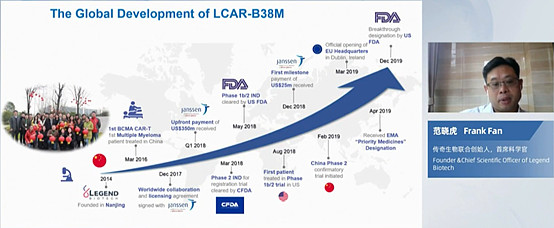
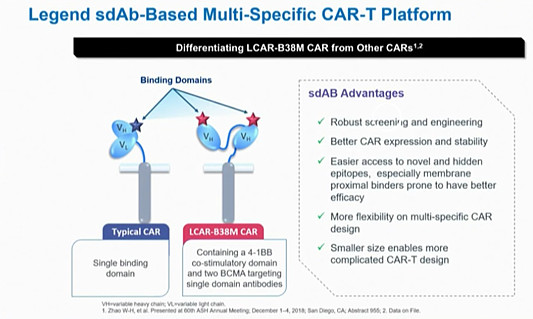
传奇生物的LCAR-B38M,是针对BCMA靶点的CART,传奇最核心的创新在于:是全球首个进入临床阶段的多表位CART,通过双表位设计显著改善了临床疗效。
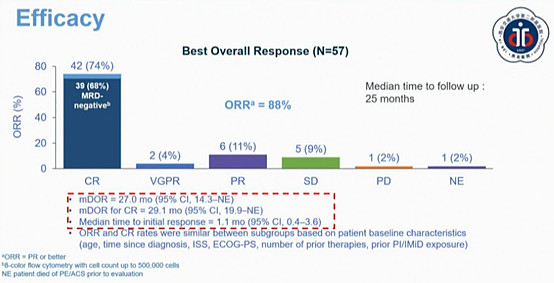
最先是在西安做的研究者临床,几年前国内多发骨髓瘤的治疗还没有CD38单抗和泊马度胺等药物,治疗非常不足,当时入组的患者有37%已经是ISS的III期,但仍然取得非常好的疗效:57位多发骨髓瘤患者,单一疗法,实现了88%的ORR和74%的CR,平均实现了27个月的缓解持续时间(DOR)。由于产品相对强效,所以采用了较低的剂量,不良风险相对还好:没有四级的CRS,有7%的3级CRS。加上临床上对CART引发的细胞因子风暴(CRS)的经验不断增加,CART相关的严重不良相对可控。
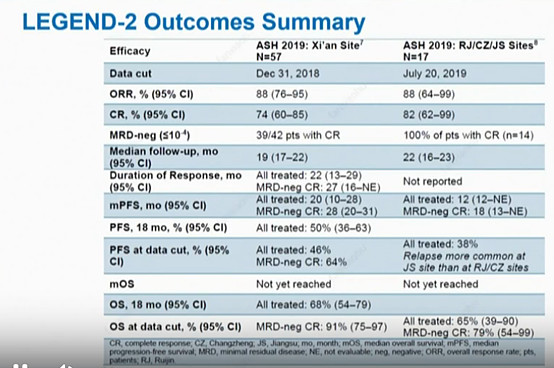
入组时患者虽然还只是3线治疗,还不算最末线,但从下图看的数据:对于CR患者在30个月时仍然欧75.5%的OS率,相比传统治疗,这仍然算是非常颠覆的疗效。

除了西安医院的研究者临床,在陈竺和陈赛娟夫妇推动下,瑞金医院牵头、长征医院和江苏省人民医院参与的东部医院开始做了更正式的临床研究。初期招募的17患者,实现了88%的ORR和82%的CR,也是很好的临床效果。
海外的临床则由强生在主导,可以看成是上海实验的改良版。美国临床用的是美国本地生产、由美国医生治疗的美国患者。患者平均接受过5线治疗,但仍然实现了100%的ORR。
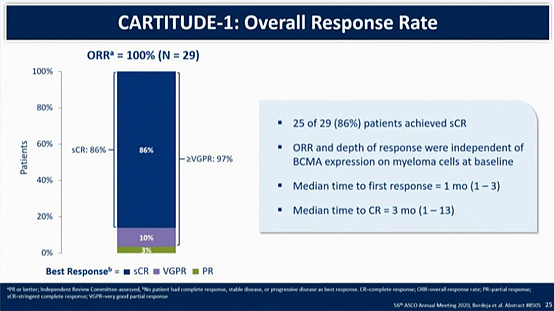
平均1个月后起效,3个月后达到CR,在强生主导的1-2期临床中,sCR随着随访时间的延长而不断上升:平均3月随访时19%、平均6月随访时66%、平均9月随访时76%、平均11.5月随访时高达86%!这是很有意思的现象,疗效不断巩固的背后,意味着CART细胞输注后的持续扩增和存活,很多患者出现了记忆细胞。

LCAR-B38M(JNJ-4528)不是进度最快的BCMA CART,但从非头对头的临床数据看:相比Juno、Bluebird、POSEIDA等竞品典型的80%-91%的ORR和35%-30%的CR,传奇CART在1期做到的100%的ORR和69%的CR率优势非常大,大概率是Best-In-Class的产品。

当然,靶向BCMA靶点来治疗多发骨髓瘤的技术路线也不只是CART,也可以通过双抗和ADC等方法来治疗,但目前为止的数据看:双抗的CR率只有30%-40%;而ADC因为毒性剂量不能太高,有效性会比双抗更低些,因此,传奇生物的LCAR-B38M(JNJ-4528)仍然可能是通过BCMA靶点治疗多发性骨髓瘤的最佳产品。
三、其它观点
除了David Chang和范晓虎分别介绍了Allogene和传奇生物核心产品之外,四位专家也就CART行业的现状和前景进行了探讨。
David Chang:CART治疗已经扩展到肿瘤之外,进入感染和免疫等疾病领域。CART是细胞工程和基因工程的合体,Allogene在研究新的工程化方法,更好了解CART的关键属性,不仅改进制造流程,也能探索其它细胞类型。适应症拓展、细胞和基因工程的扩展等会是主要的技术里程碑。推向中国市场,我们需要本土伙伴。每次往前走,安全性永远是第一大问题。产品最好是做好的,推同种异体CART就是希望让药等着病人,而不是病人等着药。
我们在考虑CART之后什么是下一步的时候,因为CART是基因疗法和细胞疗法的结合,所以我们肯定会提到基因编辑。为了从新技术获益,同源异体是非常重要的一点,整个领域就是从自体CART转向异体CART。
(注:原来的病毒载体只能往细胞里做加法,只能是导入CAR;但基因编辑技术的出现,给了我们往细胞里做减法的工具技术,我们可以利用基因编辑技术来敲除TCR等基因,这个是同种异源CART的基础;因此,一定程度上,基因编辑技术的发展,是CART由自体走向异体的必要前提。而另一方面,目前基因编辑技术的靶向和可控编辑还相对有限,更多还是血液来源细胞的体外编辑,这点上说非常契合CART的设计改造;事实上也是,制备同种异体CART是目前纳斯达克上市的基因编辑公司非常核心的应用场景。)
范晓虎:虽然3年没有新CART获批,但大家都积聚了很多能量,明年会有更多CART获批,从而鼓励整个领域,行业进展非常顺利,对细胞疗法感兴趣的人来说是最好的时期。我日本拿到博士,去加拿大读博士后,论文是递送载体以及移植的耐受性,1999年的时候,第一个基因疗法试验第一个病人很不幸去世,整个领域10年裹步不前,但不是浪费时间。回国后,觉得PD1浪潮后CART是非常好的机会。我现在的感觉是非常兴奋,还有很多学术机构和初创企业都做得很好。这个领域的人也越来越成熟。未来2-3年,CART治疗实体瘤也会突破。10年前,大家说中国人用不起单抗,现在很多人在做单抗,这些是我们想要看到的,也是必然趋势,最终我们要走的路,能够造福患者的药和疗法,要把价格降下来。CART疗法比传统疗法一定是更好的,对于总缓解率高的产品,最终一定会送达患者,我不相信价格一直这么贵,包括CMC等一定会有创新。
周剑锋: CART是非常令人兴奋的领域,作为血液病医生,没有CART不能治疗很多疾病。BCMA靶向CART疗法,将会在未来取得新的突破,将成为血液疾病的前沿疗法,尽管还需要一些时间。通用CART也是方向。预估第一款CART,可能50万甚至100万,价格太贵会影响可及性。 未来价格不会那么重要,在中国还不是这样,价格还起到一定影响。复发是个问题,成本是个问题,制造时间也是问题,通用型CART代表了方向。CART应该是整个疗法密不可分的组成部分,需要跟现有疗法结合起来。中国医生用CART的方法,是西方无法复制的,因为我们可以自己研制CART,成本更低,应该有一种商业化方法,我们能够合法使用。
(注:中国的细胞疗法是双轨制,医院可以自己制备CART,在卫健委的监管下以医疗技术的方式给患者治疗;药企则需要按照新药开发路径,完成药监局的注册流程。未来药企CART不断发展后,预计未来会以药企的法规产品为主。)
四、小结
过去10年尤其是过去5年,生物科技在“入胞技术”的引领下,大有二次起浪的势头,CART是其中兴起的重要技术之一。CART在血液瘤中的疗效堪称颠覆,虽然现在的CART仍然问题重重,但借范博士的话,就是“任何技术都不完美,尤其一开始一定不完美,然后一步一步走向完美”。我们相信在可预见的未来几年,CART技术将会有持续而长足的进步。
CART打开的,是一个全新的世界,从机理上说,这里有广阔天地。

