6 月 17 日,强生公司在官网宣布,已向 FDA 提交埃万妥单抗(amivantamab)与重组人透明质酸酶固定组合用于皮下注射的生物制品许可申请(BLA)。此次申请旨在覆盖目前已批准或已提交的所有埃万妥单抗适应症,以用于某些非小细胞肺癌(NSCLC)患者的治疗。

截图来自:强生官网
埃万妥单抗是是一款靶向 EGFR 和 c-MET 的双抗,其不仅能够抑制 EGFR 和 c-MET 表达以及其下游通路,还可将癌细胞阻碍在 G1 期并诱导细胞凋亡。
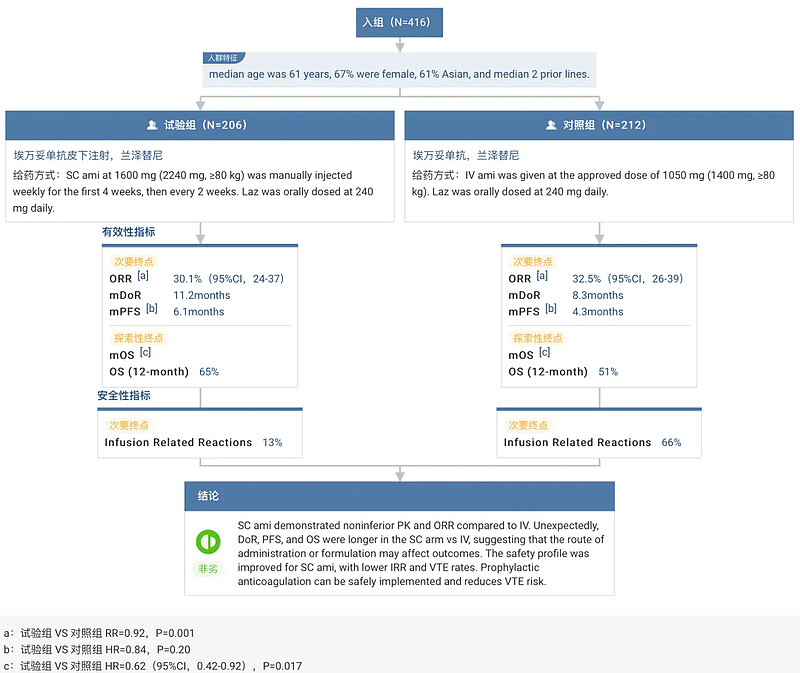
据悉,此次 BLA 递交主要基于 PALOMA-3 研究(NCT05388669)的结果。该研究评估了埃万妥单抗皮下注射(SC)与静脉注射(IV)联合兰泽替尼治疗 EGFR 19del/21 L858R 晚期 NSCLC 患者(既往使用奥希替尼和含铂化疗耐药)在药代动力学参数(PK)、疗效和安全性等方面的差异。
数据显示,与 IV 组相比,SC 组在 PK 和 ORR(30.1% vs 32.5%)方面显示出非劣效性。不仅如此,SC 组的 mDoR(11.2 个月 vs 8.3 个月)、mPFS(6.1 个月 vs 4.3 个月)均长于 IV 组。更为重要的是,SC 组在 12 个月的 OS 为 65%,显著高于 IV 组的 51%。这表明,皮下注射的方式可以更显著地提高患者的长期生存率,进而提升患者的总体预后。
安全性方面,皮下注射埃万妥单抗的安全性更好,输注相关反应(IRR)和静脉血栓栓塞(VTE)发生率也更低。
截图来自:Insight 数据库官网
综合此次试验结果来看,皮下注射的给药方式不仅在疗效上与静脉注射相当,甚至在多个关键指标上表现更佳,同时还具有更高的安全性。另外,此次 BLA 的提交还包含 2 期试验 PALOMA-2 (NCT05498428)的数据,以此来进一步支持皮下注射方案的有效性和安全性。
对于此次取得的成绩,强生公司实体肿瘤临床开发副总裁 Kiran Patel 博士表示,「静脉注射埃万妥单抗是 EGFR 突变 NSCLC 患者的基础治疗方案。然而,皮下给药选项仅需约五分钟。这是一项重要的临床进步,意味着患者、肿瘤科医生和护理人员的治疗体验将得到显著改善。我们期待与 FDA 及全球各地的监管机构合作,审查这一申请。」
目前,埃万妥单抗正在开展多项临床试验,以评估其在 NSCLC 中的疗效和安全性。这些试验涵盖了不同的基因突变类型和治疗组合,包括 EGFR 突变、EGFR 外显子 20 插入突变,以及与兰泽替尼、铂类药物和其他靶向治疗的联合应用。
转载自insight数据库:网页链接{III 期研究结果积极,强生皮下注射埃万妥单抗向 FDA 递交监管申请}