无疑是首个IO+ADC疗法了!疗效较传统化疗翻倍!
根据官方新闻,2024年3月29日——默沙东(默沙东是美国新泽西州罗威市默克公司的公司商号)宣布,中国国家药品监督管理局(NMPA)药品审评中心(CDE)已受理其PD-1抑制剂帕博利珠单抗(商品名:可瑞达®)联合enfortumab vedotin用于局部晚期或转移性尿路上皮癌成人患者的治疗的新适应证上市申请。
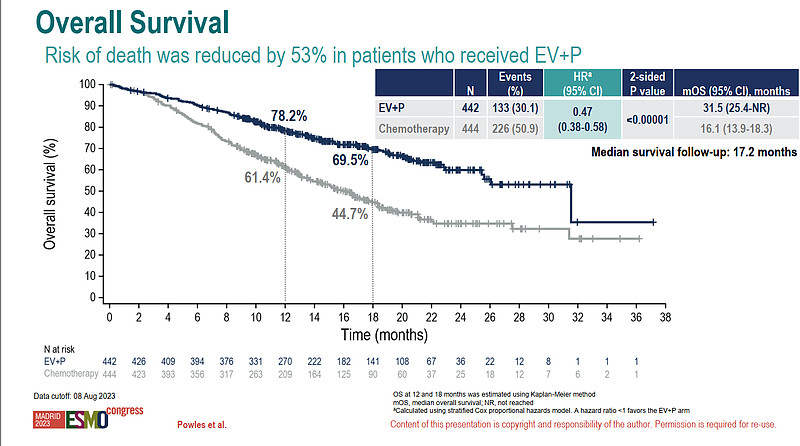
看看这个OS结果。
HR 0.47真的很牛。
中位OS上,ADC+IO组是传统化疗的2倍,31.5个月和16.1个月,提升了15.4个月!
该新适应证申请基于III期KEYNOTE-A39(EV-302)研究结果。KEYNOTE-A39研究是一项开放标签、随机、对照III期研究,用于评估帕博利珠单抗与enfortumab vedotin联合用药与化疗相比对既往未经治疗的局部晚期或转移性尿路上皮癌患者的疗效。该试验招募了可能适合或不适合含顺铂化疗方案的患者 ,无论PD-L1表达状态如何。